塩野義製薬は11月11日、塩野義とGlaxoSmithKline、Pfizer のJVのViiV Healthcareの2剤配合錠(Juluca®)について、FDAが抗HIV治療における維持療法として承認したと発表した。
同剤については2017年2月に、医療現場のニーズが高い場合に適合される「優先審査」の対象となるとの通知をFDAから受けている。通常より審査期間が4カ月前後短くなる。
Juluca®はViiV社のHIVインテグラーゼ阻害薬 Dolutegravir 50mgとJanssen Therapeutics社の非核酸系逆転写酵素阻害薬 Rilpivirine 25mgの合剤。
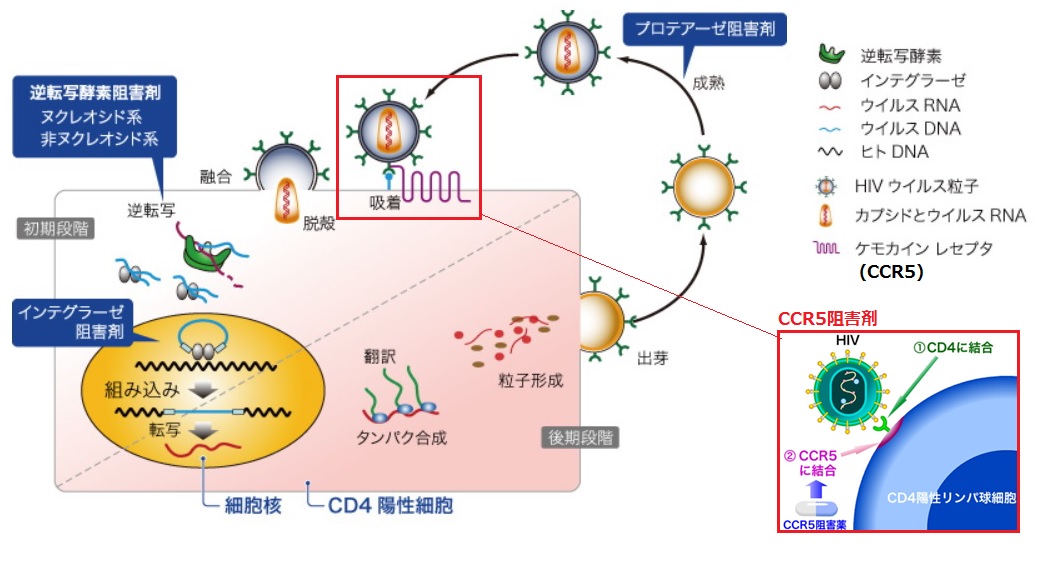
HIV治療薬には、
・核酸系逆転写酵素阻害剤、非核酸型逆転写酵素阻害剤(いずれもウイルスのRNAをDNAに変える逆転写酵素を阻害)、
・プロテアーゼ阻害剤(ウイルスのタンパク質を作る過程を阻害)、
・インテグラーゼ阻害剤(インテグラーゼの動きを止め、ウイルスDNAがヒトDNAに侵入することを防止)、
・CCR5阻害剤(HIVとCCR5受容体との結合を邪魔する)
などがあり、それぞれ作用が異なる。
http://www.hiv-resistance.jp/knowledge01.htm ほかを編集
既存のインテグレース阻害薬は、ウイルスの耐性化や1日2回投与またはブースター(薬剤を代謝する酵素を阻害する薬剤)が必要という服用の煩雑さ等があるが、Dolutegravir は、1日1回投与でブースターが不要、優れた耐性プロファイルを示すなど、次世代のインテグレース阻害薬とされる。
非核酸系逆転写酵素阻害剤、プロテアーゼ阻害剤、およびインテグラーゼ阻害剤を含む3剤以上を用いる多剤併用療法は、強いウイルス増殖抑制効果を示す。
ViiV とJanssen Sciences Ireland UC(Johnson & Johnson 子会社の Janssen Pharmaceutical Companiesの一つ)は2014年6月に2剤の合剤での開発で協力することで合意した。
塩野義は2001年9月に、GlaxoSmithKline plc.(GSK)との間で、両社の所有する複数の疾患領域における開発化合物を開発・販売することを目的とした合弁会社Shionogi-GSK Healthcare を設立した。
2002年8月に、両社はこのJVでHIV インテグレース阻害薬(Dolutegravir)に関する共同研究を開始した。
2009年10月に、GSKとPfizerは両社のHIV 治療薬を供出し、英国にViiV Healthcareを設立した。(GSK:85%、Pfizer:15%)
GSKはShionogi-GSKHealthcareの持分をViiVに譲渡し、名称をShionogi-ViiV Healthcareと改称した。
塩野義製薬は2012年10月29日、HIV治療薬JVの枠組み変更を発表した。
塩野義のShionogi-ViiV Healthcareの50%持分をViiV Healthcareに譲渡し、見返りにViiV Healthcareの10%の権利を取得する。
2012/11/2 塩野義製薬、HIV治療薬JVの枠組み変更
なお、ViiV Healthcareは2015年12月18日、米国のBristol-Myers Squibbから、開発中のHIV治療薬(最終開発段階のものと、臨床試験前の研究段階の一連のもの)を最大15億ドルで買収する契約を締結している。
2015/12/23 GlaxoSmithKline子会社ViiV Healthcare 、Bristol-Myers Squibbの開発中のHIV治療薬を取得
今回FDAの承認を得た2剤配合錠(Juluca®)は Shionogi-GSK Healthcare で開発したインテグレース阻害薬を使うもの。
非核酸系逆転写酵素阻害剤、プロテアーゼ阻害剤、およびインテグラーゼ阻害剤を含む3剤以上を用いる多剤併用療法は、強いウイルス増殖抑制効果を示す。
これまでは、3剤以上の治療薬の服用で、エイズの発症を軽減し、長期の服用によりHIV非感染者に近い余命を期待できるようになっていた。
今回の承認は世界初の2剤のみによる抗HIV療法で、医療従事者と患者に、長期間にわたる治療薬の総曝露を軽減できる新たな治療選択肢を提供する。
コメントする