塩野義製薬は2月23日、抗インフルエンザウイルス薬「ゾフルーザ錠 10mg・20mg」(一般名:バロキサビル マルボキシル、開発コード S-033188)について同日付で「A型又はB型インフルエンザウイルス感染症」の適応で製造販売承認を取得したと発表した。 薬価基準収載後、速やかに発売する予定。
塩野義製薬は2017年10月に日本国内における製造販売承認申請を行った 。
2017/10/28 塩野義製薬、新規インフルエンザ治療薬の国内製造販売承認申請
厚労省の薬食審医薬品第二部会は本年2月2日、承認することを了承している。 同省担当官は新規作用のインフルエンザ治療薬であることから審査を早めたとしている。
今回の承認取得で、先駆け指定品目では初めての承認医薬品となる。
付記
新薬「ゾフルーザ」が3月14日から保険適用されることになった。中央社会保険医療協議会が3月7日に了承した。塩野義製薬は「速やかに発売する」としている。
価格は10ミリグラム錠約1500円、20ミリグラム錠約2400円。体重60キロの成人は20ミリグラム錠を2つ(4800円)のむ。12歳未満の子どもで体重15キロなら、10ミリグラム錠を1つ(1500円)。患者側は1~3割を負担する。
付記
塩野義製薬は6月26日、同社が開発したインフルエンザ感染症治療薬バロキサビル マルボキシルについて、新薬承認申請が米国食品医薬品局(FDA)に受理され、優先審査の対象品目に指定されたと発表した。FDAの審査終了目標日は2018年12月24日。
付記
塩野義は10月25日、米国で承認を受けたと発表した。
ーーー
塩野義製薬創製の新規キャップ依存性エンドヌクレアーゼ阻害薬S-033188(ゾフルーザ錠)は既存の薬剤とは異なる作用機序でインフルエンザウイルスの増殖を抑制する新規化合物であ り、2015年10月に厚生労働省より、一定要件を満たす革新的新薬として先駆け審査指定制度(後記)の対象品目に指定されている。
塩野義では、経口の単回投与であることから、利便性が高く、治験では投与翌日には50%以上の患者(小児を含む)でウイルス力価の陰性化が認められとし、そのため「家庭内や学校、職場等でのウイルス伝播、飛沫感染拡大に対しても一定の抑制効果を示すことが期待される」としている。
非臨床試験において、鳥インフルエンザウイルス(H5N1やH7N9) や、 既存のインフルエンザ治療薬に耐性を有するウイルス株を含む、様々な亜型のA型インフルエンザウイルスに対してもウイルス増殖抑制効果が確認されている。
新規作用機序のため、耐性ウイルスが出現しても効果を発揮することも期待される。
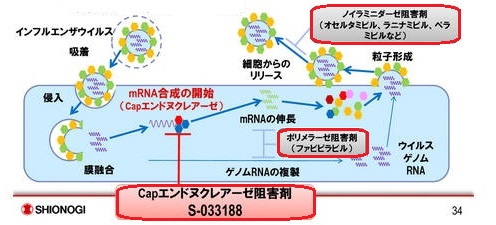
これは、ウイルスが細胞に進入後、最初の反応となるmRNA合成の開始を特異的に阻害するCapエンドヌクレアーゼ阻害剤である。
ウイルスの増殖に必要なタンパク質が合成できなくなり、ウイルス粒子が形成されなくなる。
現在、治療に用いられている抗ウイルス剤はノイラミニダーゼ阻害剤(Neuraminidase inhibitors)で、増殖されたウイルスの放出を阻害して感染の拡大を防ぐもの。
オセルタミビル(oseltamivir) Roche 商品名 タミフル
ラニナミビル(Laninamivir) 第一三共 商品名 イナビル
ペラミビル (Peramivir) 米国 BioCryst Pharmaceuticals発症後48時間以内に服用しなければ効果が得られず、タミフルの場合は5日間程度服用を続ける必要がある。
エボラ出血熱の治療に使われた富士フィルムのファビピラビル(favipiravir)(商品名アビガン)は元々インフルエンザ用治験薬で、ウイルスの細胞内での遺伝子複製を阻害することで増殖を防ぐRNAポリメラーゼ阻害剤である。
2015/11/6 塩野義製薬、インフルエンザ新薬を開発、1回投与で治療
塩野義はスイス製薬大手、ロシュと開発面で提携し、日本と台湾を除く国・地域で治験などで協力を得ている。
ロシュはタミフルの製造販売で実績があり、世界販売での連携も視野に入れる。
米国では2018年中にも米食品医薬品局(FDA)に承認申請を行う。 米国においては、塩野義は本薬を上市後にRocheと共同プロモーションする権利を留保している。
2016/3/2 塩野義製薬、新規インフルエンザ治療薬の開発でRocheと提携
ーーー
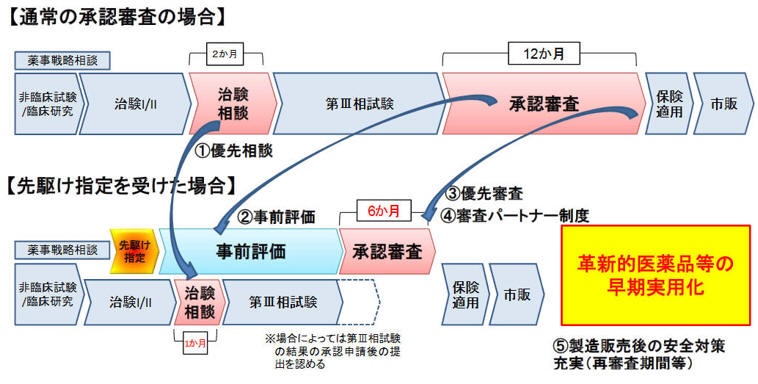
先駆け審査指定制度は、2014年6月に厚労省が取りまとめた「先駆けパッケージ戦略」の重点施策や、「日本再興戦略」改訂2014を踏まえて導入したもの。
患者に世界で最先端の治療薬を最も早く提供することを目指し、一定の要件を満たす画期的な新薬等について、開発の比較的早期の段階から対象品目に指定し、薬事承認に係る相談・審査における優先的な取扱いの対象とするとともに、承認審査のスケジュールに沿って申請者における製造体制の整備や承認後円滑に医療現場に提供するための対応が十分になされることで、更なる迅速な実用化を図る。
原則として既承認薬と異なる作用機序により、生命に重大な影響がある重篤な疾患等に対して、極めて高い有効性が期待される医薬品を指定する。
審査期間をこれまでの半分の6ヶ月まで短縮することを目指す。
医薬品 先駆け審査指定制度 対象品目
指定日 医薬品名称 申請者 対象 2015/10/27 シロリムス ノーベルファーマ 結節性硬化症に伴う線繊維腫 NS-065/NCNP-01 日本新薬 シュシェンヌ筋ジストロフィー(GMD) S-033188 塩野義製薬 A型 or B型インフルエンザウイルス感染症 BCX7353 Integrated Development
Associates遺伝性血管浮腫(HAE)の患者を対象とした血管性浮腫の発作の管理 ASP2215 アステラス製薬 初回再発or治療抵抗性のFLT3遺伝子変異陽性急性骨髄性白血病 ペムブロリズマブ
(キイトルーダ)MSD 治癒切除不能な進行・再発の胃癌 2017/4/21 オリプダーゼアルファ
(遺伝子組換え)サノフィ 酸性スフィンゴミエリナーゼ欠乏症 aducanumab バイオジェン・ジャパン アルツハイマー病の進行抑制 DS-5141b 第一三共 デュシェンヌ型筋ジストロフィー SPM-011 ステラファーマ 再発悪性神経膠腫、切除不能な局所再発頭頸部がん並びに局所進行頭頸部がん(非扁平上皮がん) ニボルマブ
(オプジーボ)小野薬品 胆道がん
他に、医療機器、体外診断用医薬品、再生医療等製品の先駆け審査指定制度がある。
コメントする