Novartis は4月9日、遺伝子治療薬開発の米 AveXis Inc. を87億ドルで買収すると発表した。1株当たり218ドルでの買収で、これは4月6日終値を88%上回る水準。
両社取締役会が全会一致で承認した。2018年半ばに手続きを完了する見通し。
難病治療の有望な新薬候補を持つ同社を買収し、遺伝子治療の製品群を広げる。
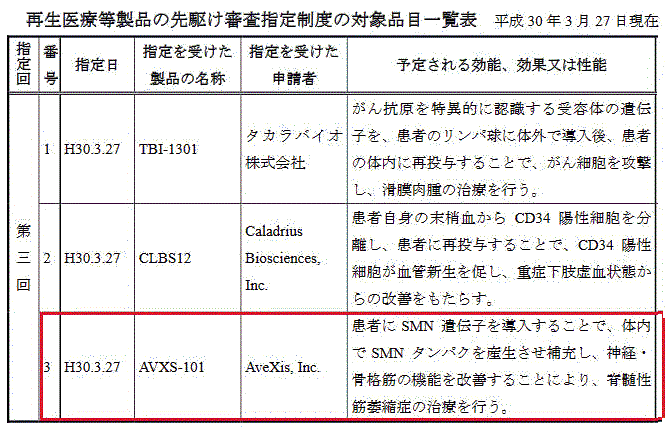
AveXis は脊髄性筋萎縮症(spinal muscular atrophy:SMA)の治療に有望な新薬候補「AVXS-101」を開発している。
脊髄性筋萎縮症(SMA)は、生存運動ニューロン(SMN1)と呼ばれる単一遺伝子の欠陥を原因とする遺伝性神経変性疾患で、体幹、四肢の近位部優位の筋力低下、筋萎縮を示す。
発症年齢、臨床経過に基づき、I型、II型、III型、IV型に分類される。I、II型の95%にSMN1遺伝子欠失が認められ、III型の約半数、IV型の1~2割においてSMN1遺伝子変異を認める。
AVXS-101は、1型SMAの治療において非常に説得力のある臨床データが得られている。同社は最近、2型SMAに対する臨床試験も開始した。
1型SMAは、乳児の遺伝的死因の第1位を占め、患者の10人中9人は2歳の誕生日を迎えるまで生きられないか、生涯にわたって人工呼吸器を必要とすることになる。
出生児の6,000~10,000人に1人は、何らかの型のSMAに罹患すると推定されている。AVXS-101は、欠陥のあるSMN1遺伝子を効果的に置き換えることでSMAの遺伝的根本原因に対処する、初の1回完結型の遺伝子置換療法となる。
臨床試験では、AVXS-101に救命効果が示されており、AVXS-101の治療を受けた15人の乳児全員が20ヵ月目にイベントフリーを達成した。
AVXS-101は、米国では画期的治療薬(Breakthrough therapy designation )、欧州ではPRIME(unmet medical needs に対応した薬剤を優先審査の対象にする制度で2016年3月に発足)、日本では画期的な医薬品を早期に実用化するため審査期間を短くする厚生労働省の「先駆け審査指定制度」の対象品目に指定されており、2019年には米国の患者に対する治療が開始される見込み。
AveXis社は、将来的に有望な遺伝子治療プログラムとその上市を加速するため、SMA以外の疾患の治療にも応用可能な遺伝子治療プラットフォームや大規模化が可能な製造技術も提供する。
Novartis は、AVXS-101 が「ピーク時には数十億ドル規模の売り上げになるポテンシャルを持つ」と期待する。
CEOは声明で「買収により、効果の高い治療法を追求し神経科学でトップ企業を目指す戦略を加速できる」と強調した。
ーーー
Novartisは2014年4月22日、大規模な事業再編を発表した。
GlaxoSmithKline (GSK) から抗がん剤製品群を買収するとともに、大衆薬事業はGSKの事業と統合し、GSK主体のJV(Novartisの出資比率は36.5%)とした。
更にインフルエンザ以外のワクチン事業をGSKに売却した。
これとは別にインフルエンザワクチンの売却を進めており、動物薬事業はEli Lillyに売却した。
2014/4/25 Novartis、GSKとの取引等で事業再編
Novartisは本年3月末に上記のGSKとの大衆薬事業JVの持分をGSKに130億ドルで譲渡することで合意した。
GSKは大衆薬事業の完全な経営権を握り、処方箋がいらない風邪薬など大衆薬ビジネスの地盤を固める。
GSKは買収資金手当てのため、麦芽飲料「Horlicks」など栄養補助食品事業の見直しに着手した。同製品群を手掛ける子会社(72.5%を所有、インド株式市場に上場)の売却を視野に入れている。
Novartisは、大衆薬事業の売却とAveXis買収で医薬品事業への集中を高める。
Novartisはまた、2018年1月にSpark Therapeuticsとの間で視機能回復のための遺伝子治療であるVoretigene neparvovec (商品名 Luxturna) の米国外における権利について、ライセンス契約を締結している。
voretigene neparvovecは、RPE65(網膜色素上皮特異的に発現する分子量約65 kDaの蛋白質)遺伝子の両アレル性変異を有する小児および成人患者の視機能の回復を目的とした単回の遺伝子治療として、2017年12月19日にFDAから承認を取得した。
患者のRPE65遺伝子の正常な機能を回復することで、未治療のままでは失明に至る可能性が高い進行性の視覚障害を治療する。
欧州医薬品庁(EMA)への医薬品販売承認申請(MAA)は、2017年7月31日に提出している。
現在のところ、米国外でこの疾患に対する治療法はない。
Novartisは、米国外のすべての国で開発、承認申請および販売に関する独占権を保有する。
Spark Therapeuticsは、Novartisと別途締結される製造供給契約に基づき、voretigene neparvovecを世界各国に供給する。
コメントする