米FDAは9月28日、米バイオ企業のINOVIO Pharmaceuticalsが開発中の新型コロナウイルス感染症ワクチンINO-4800 と接種装置CELLECTRA® 2000 について、最終段階のPhase 2/3 臨床試験(治験)開始の保留を決定した。
| Developer/manufacturer | Platform | Type | doses | Timing | Route | Phase | |||
| 1 | 1/2 | 2 | 3 | ||||||
| INOVIO Pharmaceuticals(米)/ International Vaccine Institute |
DNA | DNA plasmid vaccine with electroporation電気穿孔法 | 2 | 0, 28 days | ID | 〇 | 今回保留 | ||
INOVIOのワクチンINO-4800は、公表されたSARS-CoV-2の遺伝子配列に同社専有のDNA医薬技術を適用して速やかに設計されたDNAワクチンで、同社によると、INO-4800の特徴は液性免疫と細胞性免疫をバランスよく誘導できる点にある。
INOVIOはコロナウイルス関連事業の経験が豊富で、中東呼吸器症候群(MERS)を引き起こす関連コロナウイルス用の第2相ワクチンを有する唯一の企業である。
また、INO-4800は非常に安定で室温でも1年以上変質しない唯一の核酸ベースのワクチンで、室温で1年超保管できるため冷凍して輸送や保管をする必要がない。世界各国で幅広く接種することが可能である。
このワクチンは同社独自の接種装置CELLECTRAを使って接種する。(今回、これに関する追加情報が求められた。)
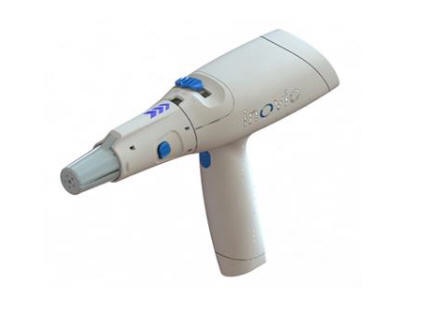
INOVIOのDNA医薬品は、CELLECTRAと呼ばれるINOVIO独自の携帯スマートデバイスを使用して、最適化されたプラスミドを筋肉注射または皮内注射で細胞に直接送達する。
CELLECTRAデバイスは、短い電気パルスを使い、細胞内に小さな孔を可逆的に開けてプラスミドの侵入を可能にしている。細胞内に入ったDNAプラスミドは、細胞が目的とする抗原を生成できるようにする。
抗原は細胞内で自然に処理され、望ましいT細胞と抗体を介した免疫反応を引き起こす。
CELLECTRAデバイスを使用した投与により、DNA医薬品が体の細胞に直接送達され、そこで直ちに免疫反応を引き起こしにかかることが可能になる。
CELLECTRAは、単3電池で動作する。厳しい環境でも確実に動作するよう設計されており、保守なしで大量に備蓄できるというパンデミック状況下では極めて重要な特性を備えている。
INOVIOのサンディエゴ・デバイス製造施設は同デバイスの初期量を生産済みで、設計や製造プロセスの規模拡大を契約メーカーに委託して供給をさらに増やす。
同社は6月に、40人の健康なボランティアを対象にワクチン候補を2回投与した第1相試験の治験で6週目に参加者の94%が全般的な免疫反応を示したと報告した。
このため、米国防総省から7100万ドルの資金提供を受け、INO-4800を直接皮内に送達するために使用するCELLECTRAスマートデバイスの大規模製造と調達に振り向けると発表した。
コメントする