今年のノーベル医学・生理学賞受賞者はmRNAワクチンの開発者のKatalin Kariko とDrew Weissmanではないかと言われている。
当初、COVID-19ワクチンの開発は1年では無理と言われていた。
しかし、米国では2020年12月に2つのワクチンが緊急使用許可を得て、接種されている。
BioNTech/Pfizerの「BNT162b2」と、Modernaの「mRNA-1273」である。
いずれもmRNAワクチンで、Katalin Kariko とDrew Weissmanの研究が基になっている。
| Developer/manufacturer | Platform | Type | doses | Timing | Route | 承認 |
| BioNTech(独)/ Pfizer | RNA | 3 LNP-mRNAs | 2 | 0, 28days | IM |
UK 2020/12/2 |
| Moderna / NIAID | RNA | LNP-encapsulated mRNA | 2 | 0, 28 days | IM |
FDA 2020/12/17 |
一般のワクチンは、ウイルスの蛋白質を体内に送り、抗体をつくる。このため、新しいウイルスの場合、手間と時間がかかる。
ウイルスベクターワクチン:ウイルスベクターに抗原たんぱく質の遺伝子を組み込む。
DNAワクチン:抗原たんぱく質の塩基配列を作る情報を持ったプラスミド(環状)DNAのワクチン
組み換えたんぱく質ワクチン:ウイルスの構成成分である抗原たんぱく質を昆虫細胞や植物、哺乳動物細胞などで作り、単離・精製
組み換えVLPワクチン:ウイルスのゲノムを含まない外殻たんぱく質のみを微生物や昆虫細胞、植物で作り、単離、精製
不活化ワクチン:ウイルス自体を培養し、ウイルスの感染性や病原性を消失させたもの
これに対し、mRNAワクチンは、抗原タンパク質を直接導入するのではなく、ウイルスのタンパク質分子の情報を運ぶ。BNT162b2やmRNA-1273はSARS-CoV-2の特徴であるスパイク部分の設計図をコピーしている。
ウイルスの細胞内では核のDNAの情報を転写し、mRNAが合成される。mRNAはタンパク質の合成場所であるリボソームに移動、そこで情報を翻訳して元のタンパク質が合成される。
mRNAワクチンでは、ウイルスのスパイク部分の設計図をもつmRNAを人体に投与し、人体のタンパク質合成機構がこの情報を使ってウイルスのスパイクタンパク質を作成、これが抗体となって、T細胞、B細胞を活性化する。 ワクチンの mRNA そのものはタンパク合成を指令したあと分解されてしまい、ワクチン由来の人工的な遺伝子は体に残らない。
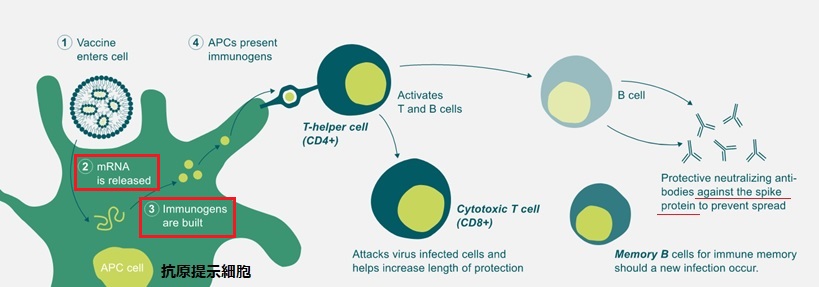
このため、SARS-CoV-2の遺伝子配列さえ分かれば、 その設計図である mRNAワクチンは簡単に作成できる。
実際にBNT162b2はその構造が公表されており、世界のどこの研究室や工場でも、このワクチンを再現できるという。
AGAAΨAAAC ΨAGΨAΨΨCΨΨ ・・・
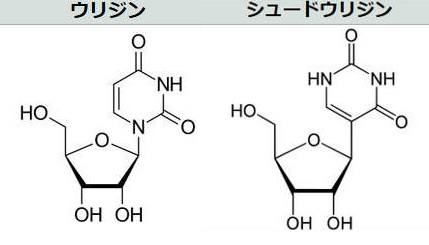
mRNAは、「アデニンA」「ウラシルU」「シトシンC」「グアニンG」という4種類の塩基からなる。この場合、ウラシルUがシュードウリジン(Ψ)に置き換えられている。(後記)
ウイルスが変異すれば、それに合わせてワクチンを簡単に改良できる。
BioNTech / Pfizer とModernaは、これまでに特定された最も懸念される変異株に対応するため、ワクチンのバージョンアップを検討している。
2019年12月31日、中国武漢で肺炎患者が44人発生したことが報告され、2020年1月5日にはWHOが未知の感染症について警告を発した。
2020年1月11日、新型コロナウイルスSARS-CoV-2の遺伝子配列が読み取られて発表され た。
ModernaがmRNAワクチンの候補数種類を設計したのはそのたった2日後の1月13日とされる(異論もある)。その中には承認されたmRNA-1273が含まれている。
コロナウイルスの拡大を懸念したBioNTechのUğur Şahin CEOは、2020年1月に「倫理的な責任」としてワクチン開発に着手すべきと判断、自らいくつかのワクチン候補を設計したという。
Pfizerは mRNAワクチンの検討をしていたが、mRNA技術を使ってがん治療薬を開発していたBioNTechに 注目し、両社は2018年8月にmRNAをベースとしたインフルエンザワクチンの研究を始めていた。
2020年3月にPfizerとBioNTechは、mRNAワクチン BNT162の開発を加速することを目的として、COVID-19感染予防を目的とするmRNAワクチンの共同開発および流通(中国を除く)に関する覚書を締結した。
両グループが早期に開発に成功したのは、以前から準備していたからである。新型ウイルスのスパイクの配列を埋め込めば設計図が完成するように準備されていた。
いずれもBioNTechの上級副社長 のKatalin Karikoが免疫学者のDrew Weissman と共同で2005年に発表した論文が基になっている。
この論文は当初は余り注目されなかったが、ModernaやBioNTech、Pfizerなどは見落とさなかった。
ーーー
Katalin Karikoはハンガリー出身で、セゲド大学在学中からRNA研究に取り組んだ。主要研究はRNAの免疫原性を抑制するヌクレオシド修飾プロセスの発見で、mRNA研究の臨床応用への道を開いた。
1985年に夫と娘と共に渡米し、ペンシルベニア州のテンプル大学でポスドク研究員として働き始めた。しかし、テンプル大学の上司が国外退去させようとしたため、4年間務めた同学を辞職してペンシルベニア大学に籍を移した。
mRNAの抗ウイルス応答が癌ワクチンの腫瘍予防に有効であることが分かったが、応募を重ねても研究助成金がまったく得られず、大学では降格された。
"Every night I was working: grant, grant, grant," Karikó remembered, referring to her efforts to obtain funding. "And it came back always no, no, no."
そのなかで学内で免疫学者のDrew Weissmanと知り合い、共同研究から生まれたのが上記の論文である。
Dr. Weissman は現在、University of PennsylvaniaのPerelman School of Medicine の教授。
mRNAはDNAの遺伝情報をたんぱく質に翻訳する橋渡しの分子である。DNAの情報は転写プロセスでmRNAに写し取られ、mRNAは細胞核から細胞質に移動し、リボソームがmRNAをタンパク質に翻訳する。このタンパク質が細胞や組織で各種の役割を担う。
Katalin KarikoはmRNAを直接、体に投与し、治療やワクチンに必要なたんぱく質を細胞に作らせることを狙った。
問題は注射すると身体の免疫系が異物と認識し、炎症反応を引き起こす。
mRNAは、「アデニンA」「ウラシルU」「シトシンC」「グアニンG」という4種類の塩基からなる。その一つ が問題であることが分かり、それをわずかに細工すること(RNA修飾)で免疫系をすり抜け、炎症を回避し、細胞にたんぱく質を作らせる手法 を考えた。
The stumbling block, as Karikó's many grant rejections pointed out, was that injecting synthetic mRNA typically led to that vexing immune response; the body sensed a chemical intruder, and went to war. The solution, Karikó and Weissman discovered, was the biological equivalent of swapping out a tire.
Every strand of mRNA is made up of four molecular building blocks called nucleosides. But in its altered, synthetic form, one of those building blocks, like a misaligned wheel on a car, was throwing everything off by signaling the immune system. So Karikó and Weissman simply subbed it out for a slightly tweaked version, creating a hybrid mRNA that could sneak its way into cells without alerting the body's defenses.
ウラシルから誘導されるヌクレオシドはウリジンであるが、ウリジンをシュードウリジン(Ψ)などに置き換えると、mRNAの二次構造が変化し、効果的な翻訳を可能にしながら、自然免疫系による認識を低下させる 。
mRNAワクチンはこの発明により可能となった。
2005年、ハーバード大学の幹細胞生物学者のDerrick Rossiは、彼らの論文は「根底をくつがえす」ものだとしてノーベル化学賞に匹敵すると述べた。彼は2010年にワクチン開発の可能性を見出してmRNAに焦点を当てたバイオテクノロジー企業Modernaを設立した。
付記 Karikoは次のように述べている。(2021/3/14 毎日新聞オンライン)
幹細胞生物学者のDerrick Rossiは当時、山中伸弥教授が発見したiPS細胞を作ろうとする過程で、mRNAを活用しようと考えていた。ところがmRNAを入れた細胞は死に、うまくいかなかった。
さまざまな方法を探る中で私たちの論文に行き着き、実際に私たちが発表した方法に基づいて修飾したmRNAを使えばiPS細胞が樹立できたのです。
もし山中教授がいなければ、もしiPS細胞の発見がなければ、私たちの論文が「発見」されることはなかったかもしれません。
KarikoとWeissman の研究技術のライセンスを受けたBioNTech はmRNAワクチンなどの開発に焦点を絞り取り組んだ。
BioNTechは2008年に、トルコ系ドイツ人の科学者であるUğur Şahinと彼の妻である Özlem Türeci、オーストリアの腫瘍学者のChristoph Huberによってドイツで設立された。
2013年にKarikoがBioNTechのSenior Vice President に就任した。
個別化されたがん免疫療法、感染症に対するワクチン、希少疾患のタンパク質補充療法に使われるメッセンジャーRNAをベースとした医薬品候補を開発しているほか、癌の治療オプションとしての細胞療法、新規の抗体、低分子免疫調節剤を開発している。mRNAをベースとした静脈内へ投与するためのヒト向け治療法を開発した。
BioNTechはmRNA技術を使ってがん治療薬を開発していたが、2020年1月に「倫理的な責任」としてワクチン開発に着手すべきと判断した。
ーーー
2021年1月30日の毎日新聞で青野由利 専門編集委員が「カタリンの物語」を書いている。
カリコさんはなぜ、mRNA医薬に興味と確信を持ち続けてきたのか。メールでたずねてみた。
「80年代の終わりから焦点があてられた遺伝子治療の目的はDNAを細胞に送り込み永続的に働かせること。でも、多くの病気は遺伝性ではなく、治療は一時的であるべきで、mRNAを使う方が合理的だと思ったのです」。
mRNAは迅速に作ることができ、改良を重ねられたことも利点らしい。
* ワクチンの mRNA そのものはタンパク合成を指令したあと分解されてしまい、ワクチン由来の人工的な遺伝子は体に残らない。
コメントする