理化学研究所、東京大学、京都大学、科学技術振興機構は4月19日、共同研究グループが 新型コロナウイルス由来のウイルスRNAを「1分子」レベルで識別して5分以内に検出する革新的技術の開発に成功したと発表した。次世代の感染症診断法の核心技術としての応用展開が期待でき るとしている。
本研究は、科学雑誌『Communications Biology』のオンライン版(4月19日付)に掲載された。
現在行なわれているPCR検査は、検出に最短で1時間程度かかり、検出エラーも発生することから、大量の検体を短時間かつ高精度に解析することが困難である。
今回、SARS-CoV-2由来のウイルスRNAを「1分子」レベルで識別して5分以内に検出する革新的技術、SATORI 法(CRISPR-based amplification-free digital RNA detection法)を開発した。
ウイルスの遺伝物質があると活性化する酵素を利用する。
採取した唾液など検体の中のウイルスの殻を界面活性剤などで壊し、この酵素が入った溶液と混ぜ、微小な試験管が集まったプレート上で反応を見る。
酵素が活性化すると光る蛍光物質を検出することで、陽性だと確認する。
これは下記の2つの先進技術を融合したもの。
理化学研究所の渡邉力也主任研究員グループが専門とする「マイクロチップを利用した酵素反応の1分子検出技術」
半導体製造プロセスを活用して微細構造をチップ上に造形する技術 で、容積3フェムトリットルの世界最小レベルの微小試験管を約100万個集積したマイクロチップを造形した。
東京大学の西増弘志教授、濡木理教授グループの「核酸切断酵素CRISPR-Cas13a(Cas13a)」
多くの細菌は、「CRISPR-Casシステム」と呼ばれる獲得免疫システムを備えている。 CRISPR-Cas獲得免疫システムは6つのタイプ (I~VI型) に分類されている。
VI型CRISPR-Casシステムに関与するCRISPR-Cas13aは、ガイドRNAと複合体を形成し、ガイドRNAと相補的な1本鎖RNAと結合すると活性化し、1本鎖RNAを切断するRNA依存性RNA切断酵素である。
SATORI 法の仕組みは次の通り。
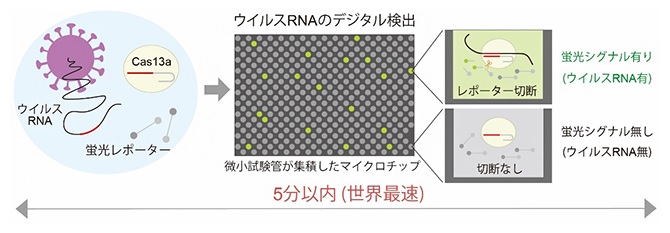
核酸切断酵素Cas13a (ガイドRNAと結合)と蛍光レポーター、検体のウイルスRNAを混ぜると、特異的にウイルスRNAとCas13aの複合体が形成される。
ガイドRNAをウイルスRNAと結合するよう設計しておくと、Cas13aとウイルスRNAの複合体ができる。
複合体が形成されるとCas13aの酵素活性がオンとなり、蛍光基と消光基がつながった蛍光レポーターが切断される。
蛍光レポーターは、標的RNAとCas13aの複合体を検出するための蛍光性の機能分子 で、核酸のウラシル(U)が五つ連なった1本鎖RNAの両端に、それぞれ蛍光基と消光基が結合した構造を持つ。複合体はウラシルが連なった構造を特異的に切断する性質を持つため、蛍光レポーターが複合体により切断されると、蛍光基は消光基から物理的に解離し、蛍光を発するようになる。
これを微小試験管が100万個集積されたマイクロチップアレイに小分けにして封入すると、ウイルスRNAが存在する微小試験管だけ蛍光シグナルが1分以内に上昇する。
マイクロチップのデジタル信号からシグナル有の微小試験管の個数をカウントする。カウントされる試験管の個数はサンプル中のウイルスRNAの個数に相当する。
検出感度は5フェムトモーラー(fM、fMは1000兆分の1モーラー)で、新型コロナウイルス感染者の検体中のウイルスRNA量を検出する感度を満たしている。
ランニングコストは9ドル程度と安価であるという利点もある。(PCR検査は5ドル程度)
グループは来年度中の臨床試験開始をめざす。
また、SATORI法は、疾患バイオマーカーの検出などにも活用できるため、がんなどの基礎疾患の早期・層別化診断などを指向した次世代のリキッドバイオプシ ー(血液や尿などの身体への負担が少ない低侵襲性の液性検体の解析を基盤とした基礎疾患・感染症の診断方法)の技術基盤となることも期待できるとしている。

コメントする