米食品医薬品局(FDA)は6月7日、エーザイと米バイオジェンが共同で開発するアルツハイマー型認知症治療薬候補ADUHELM(一般名:アデュカヌマブ)について、脳内のアミロイドβプラークを減少させることにより、アルツハイマー病の病理に作用する初めてかつ唯一の治療薬として、迅速承認(accelerated approval)したと発表した。
従来の認知症薬とは異なり、認知機能の低下を長期的に抑制する機能を持つとして世界で初めて承認された。
アミロイド斑(プラーク)は、アミロイドβ蛋白が蓄積したもので、アルツハイマー病患者の脳にみられる。新薬はこのレベルを下げるもの。
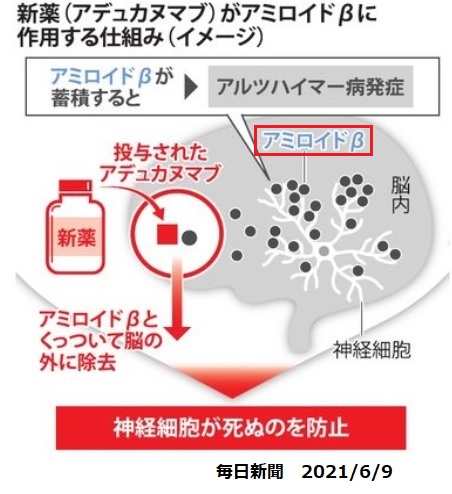
今回の迅速承認は、アミロイドβプラークの減少に対するADUHELMの効果を実証した臨床試験のデータに基づくもので、迅速承認の要件として、今後検証試験による臨床的有用性の確認が必要となる。
ADUHELMの有効性は、アミロイドの蓄積が確認されたアルツハイマーの初期段階(軽度認知障害および軽度認知症)の患者を対象とした2つの臨床第III相試験で評価された。
また、ADUHELMの効果は、プラセボ対照無作為化二重盲検用量設定第Ib相試験においても評価された。
付記
下記の通り、米国食品医薬品局(FDA)の末梢・中枢神経系薬物諮問委員会 は、 投票の結果、有効性に対して否定的な見解を公表していた。
諮問委員会の提言は拘束力はないが、提言に反する承認は異例。
今回の承認をめぐり、委員会のメンバーのうち、反対票を投じた大学の神経学者と、当日の採決に加わらなかった医療機関に勤める人物の2人が辞任した。委員会の反対にもかかわらずFDAが、条件付きで承認したことへの抗議だという。
ーーー
エーザイとBiogenは2014年3月に提携を開始した。
現状は次の通りで、アリセプトを除き、開発で提携している。
エーザイは今回のアデュカヌマブのほか、Biogenと共同開発しているアルツハイマー治療薬BAN2401について2022年度中に承認申請を目指している。
2020/9/24 エーザイ、認知症薬を2022年度に承認申請へ
| エーザイ | アリセプト 〈提携対象外〉 (donepezil) |
エーザイの杉本八郎博士らが開発 |
アルツハイマーでは、神経伝達物質のアセチルコリンが脳内で減少している。
アセチルコリンを分解するアセチルコリンエステラーゼの作用を阻害することで、アセチルコリンの濃度を高める。 |
| 新規ヒト化モノクローナル抗体 「BAN2401」 2022年度中に申請 |
2007/12 スウェーデンのBioArctic Neuroscience ABから全世界の研究・開発、製造、販売の独占ライセンスを受ける。 | アルツハイマー病の原因と考えられるベータ・アミロイド成分を除去 | |
| βサイト切断酵素(BACE)阻害剤 elenbecestat「E2609」 x試験中止 |
エーザイが創製
|
アミロイド前駆体タンパク質のβサイト切断酵素であるBACEを阻害することでβアミロイドの総量を低下させる。 | |
| Biogen | 抗アミロイドβ(Aβ)抗体 aducanumab(BIIB037) x→ 申請→FDA優先審査 2021/6/7 迅速承認 |
Neurimmune社より共同開発およびライセンス契約締結のもとに導入 | アミロイド斑(プラーク)は、アミロイドβ蛋白が蓄積したもので、アルツハイマー病患者の脳にみられる。
aducanumab 投与でアミロイドプラークのレベルを下げる |
2017/10/27 エーザイとバイオジェン、アルツハイマー治療剤での提携契約を拡大
本剤はBiogenが開発したもので、一旦は中止を決定していたものである。
両社は2019年3月21日、aducanumab(BIIB037)の有効性、安全性を評価する臨床第III相国際共同試験(ENGAGE試験、EMERGE試験)を中止することを決定したと発表した。
本試験において主要評価項目が達成される可能性が低いと判断されたことに基づくものであり、安全性に関する問題によるものではない。
しかし、結果を再分析したところ、高用量を投与した一部の患者に効果が確認できた。重篤な副作用も認められなかった。
両社2019年10月22日、早期アルツハイマー病患者を対象に臨床試験を実施した抗アミロイドβ(Aβ)抗体アデュカヌマブ(aducanumab:BIIB037)について、Biogenが米国食品医薬品局(FDA)との協議に基づいて、新薬承認をめざすことを発表した。
Biogenは2019年12月5日、2020年初めに米国で承認申請すると発表していたアルツハイマー病治療薬「アデュカヌマブ」について、投与した患者の認知機能の低下スピードが2割ほど遅くなったとする臨床試験(治験)のデータを学会で発表した。
投与量を増やした患者の認知機能の低下が22%抑えられたほか、日常生活への影響も40%抑えるデータを報告した。
専門家は「投与量が増えると効果が出ることが明確に示された」としている。
2020年11月7日、アルツハイマー病治療薬候補であるアデュカヌマブについて、米国食品医薬品局(FDA)の末梢・中枢神経系薬物諮問委員会が開催された。
投票の結果は下記の通りで、有効性に対して否定的な見解を公表した。
FDA諮問委員会の提言は、FDAによる審査において考慮されるが、拘束力はない。
2019/10/24 Biogenとエーザイ、一旦治験中止したアルツハイマー薬の承認申請へ
FDAは当初、2021年3月に判断するとしていたが、追加データを求め、3か月延長した。
諮問委員会の提言は拘束力はないが、提言に反する承認は異例。
コメントする