Pfizerは9月27日、COVID-19治療薬を予防薬としても使う EPIC-PEP(COVID-19 暴露後の予防のためのプロテアーゼ阻害薬の評価試験)のPhase2/3の開始を発表した。 感染した人と同居する人を対象とする。
* Evaluation of Protease Inhibition for COVID-19 in Post-Exposure Prophylaxis
新薬候補のPF-07321332とエイズウイルス感染症の治療に使われるリトナビル(ritonavir)(低用量)を併用する。
今回の Phase 2/3 テストはグローバルな研究計画の一部で、感染した人と同居する18歳以上の2660人を対象としている。
PF-07321332/ritonavir 合剤かプラセボを1日2回、5日又は10日経口投与し、安全性と感染と症状の予防の有効性を評価する。
このテストに加え、2021年7月に始まったグローバルなEPIC-PEPには、重症化(入院、死亡を含む)のリスクが高い感染患者を含めた試験、8月に始まった重症化リスクのない感染患者に対する試験がある。
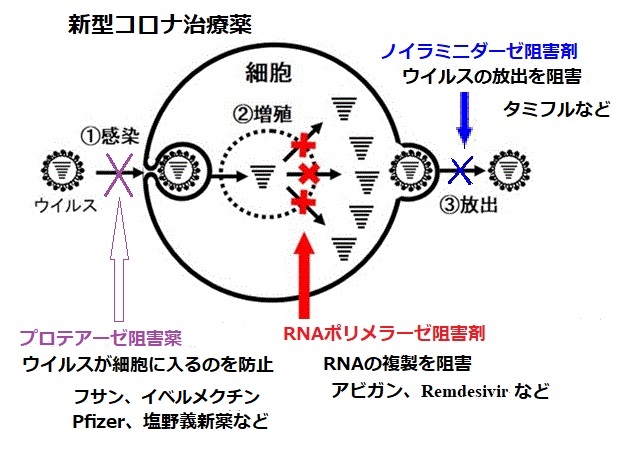
PF-07321332はプロテアーゼ阻害薬(下図)で、特に経口投与するように設計されているため、患者を入院させることなく、感染の最初の兆候または曝露の最初の認識時に処方できる可能性がある。(臨床試験で評価された最初の経口投与薬。現在承認されているものはない。)
低用量のリトナビル(これも経口投与)との同時投与は、PF-07321332の代謝または分解を遅らせ、ウイルスとの闘いを助けるために高濃度で長期間、体内で活性を維持するのに役立つと期待している。
Ritonavir もプロテアーゼ阻害薬で、同じくプロテアーゼ阻害薬のLopinavirとの合剤(AbbVie Inc.が販売する商品名Kaletra)がHIV感染症のHAART療法に用いられている。
Remdesivir 国際的な臨床試験を行ったが、その中にプロテアーゼ阻害薬のLopinavirとRitonavir の合剤(商品名Kaletra)が含まれている。
2020/10/17 WHO、暫定結果で「Remdesivirの効果認められない」、メーカーは反発
AbbVie Inc.は2020年5月に注意を出している。
ロピナビル・リトナビルは、成人及び小児のHIV感染症の治療薬として承認されている抗ウイルス化学療法剤です。現在、本剤がCOVID-19に適応外使用されていることを把握している。これまでに、COVID-19に対して本剤が使用された場合の新たな安全性の問題は出ていない。 しかし、本剤のCOVID-19に対する承認は取得しておらず、その有効性・安全性は確立していないため、COVID-19に対する使用にあたっては、必要性やリスクを十分に検討してほしい。
Pfizer は2021年3月、PF-07321332を健康な成人を対象とした第1相試験で、治験薬の安全性、忍容性、および薬物動態を評価した。
7月には、フェーズ2/3試験であるEPIC-HR(高リスク患者におけるCOVID-19のプロテアーゼ阻害の評価)に進み、リトナビルと組み合わせて、診断が確定した参加者の有効性と安全性を評価した。8月にはフェーズ2/3試験であるEPIC-SR(標準リスク患者におけるCOVID-19のプロテアーゼ阻害の評価)を開始し、SARS-CoV-2感染の診断が確定した参加者の有効性と安全性を評価した。
ーーー
米国のMerckも経口治療薬を開発している。こちらはRNAポリメラーゼ阻害剤である。
米製薬大手Merck (米加以外での社名はMSD : Merck Sharp and Dohme)は6月9日、開発中の新型コロナウイルスの経口治療薬「モルヌピラビル Molnupiravir」について、米政府への供給で合意したと発表した。
モルヌピラビルは、ウイルスの増殖を防ぐ飲み薬で、米国などで最終段階の治験が行われており、有効性などが確認できれば今年後半にも米当局に緊急使用許可を申請する可能性があるという。
感染者と接触した後に、感染の予防薬としてモルヌピラビルを飲んだ場合の効果を調べる試験も今年後半に始める。
モルヌピラビルはMerckと米バイオ医薬品企業 Ridgeback Biotherapeuticが共同開発するもので、アビガンと同様、ウイルスの細胞内での遺伝子複製を阻害することで増殖を防ぐRNAポリメラーゼ阻害剤である。
2021/6/15 米Merck、新型コロナウイルス治療薬の米政府への供給で合意
Merck と共同開発社のRidgeback Biotherapeutics は9月1日、Phase 3 の治験を開始したと発表した。
付記
Merckは10月1日、開発する新型コロナウイルスの飲み薬について、臨床試験(治験)で入院と死亡のリスクを50%減少させることが確認されたと発表した。
今後、米食品医薬品局(FDA)に緊急使用許可を申請する見通し。付記
Merckは11月26日、治験の最終分析で、入院と死亡のリスクを(前回発表の50%ではなく)30%減少させることが確認された発表した。前回より有効性が低下した。
(参考)
Merck はイベルメクチンを開発した。同社は2021年2月4日、イベルメクチンを新型コロナウイルス感染症治療に使う可能性についてデータを検証したところ、安全性と効果は示されなかったと発表、寄生虫病の治療以外の用途で使用すべきでないと警告した。
日本では疥癬用に販売しているが、この用途以外には製品を供給していない。
価格が安いため販売しないのだとする声があるが、このモルヌピラビルを高価格で売るためだったのか? (イベルメクチンは疥癬用で安価なため、大量に売っても利益は少ない。)
興和は7月1日、大村智博士の要請を受け、新型コロナウイルス感染症患者を対象にイベルメクチンを投与する臨床試験を開始すると発表した。
なお、通販ではインドのSun Pharmaのジェネリック品 Ivermectol が販売されている。数量によるが、@152(144錠の場合)、@500(4錠の場合)となっている。
中外の抗体カクテルは@31万円とされる。
ーーー
塩野義製薬は新型コロナウイルス感染症(COVID-19)治療薬(開発番号:S-217622)を経口投与の薬として開発中だが、国内第2/3相臨床試験を9月27日に開始した。2021年7月より国内第1相臨床試験を開始したが、現時点で、安全性上の大きな問題は認められておらず、薬物動態についても、目標とする血中薬物濃度を上回る良好な結果が確認されている。
3CLプロテアーゼ阻害薬で、SARS-CoV-2の3CLプロテアーゼを選択的に阻害することで、SARS-CoV-2の増殖を抑制する。
形状はまだ決まっていないが、錠剤やカプセルなどを想定している。
2021/7/28 塩野義製薬、COVID-19治療薬の臨床試験開始
付記 経口投与治療薬(飲み薬)について新しい発表があった。
年内に薬事法申請し、来年1~3月に実用化の予定
年度内(2022年3月末まで)に100万人分を生産
海外供給も視野に国際共同治験も計画しており、年内に米FDA、欧州医薬品庁(EMA)と協議に入る。
なお、塩野義製薬は7月19日に東京大学発の創薬ベンチャーである株式会社HanaVaxとの間でカチオン化ナノゲルデリバリーシステムを用いたCOVID-19に対する新規経鼻ワクチンの開発に関するライセンス契約を締結したが、2022年度から臨床試験(治験)を始める。
呼吸器感染症に対するワクチンは、全身系の免疫に加えて、病原体の侵入門戸である呼吸器粘膜に「粘膜免疫」を誘導できる経鼻ワクチンがもっとも有効なワクチンと考えられているが、カチオン化ナノゲルデリバリーシステムは、天然に存在する多糖のプルランをコレステロール修飾、およびカチオン化修飾することにより粘膜保持性を高めたもので、ワクチン抗原をナノゲル内に封入し、経鼻投与を介して粘膜に導入することで、全身系および粘膜系両方の免疫を効果的に誘導することが期待される。
コメントする