塩野義製薬は2月7日、COVID-19治療薬「S-217622」に関する説明会を開き、Phase 2/3試験 Phase 2a partの結果を速報した。
対象患者は、軽症中等症および無症候軽度症状のみの感染者で、1日1回を5日間 経口投与した。
結果は次の通り。
• 抗ウイルス効果:プラセボと比較して有意に優れた抗ウイルス効果を示した
> 速やかにウイルス力価およびウイルスRNA量を減少
> 4 日目(3回投与後)にはウイルス力価陽性患者割合をプラセボ群と比較して約60~80%減少
> ウイルス力価が陰性になるまでの時間の中央値を、プラセボに対して2日短縮
• 臨床症状に及ぼす影響:COVID-19に特徴的な臨床症状の改善傾向を確認した
> プラセボ群における重症化症例は2例存在したが、S-217622投与群ではいずれの群においても認められなかった
• 安全性
- 高度、重篤ならびに治験中止の原因となる有害事象は見られなかった
- ほぼ全ての有害事象は軽度であり、副作用も全て軽度であった
2月14日の週あるいはその次の週というタイミング、2月中には間違いなく結果とともに承認申請というようなプロセスを取るべく準備。
対象は12 歳以上だが、小児の開発はどうしてもしなければいけないと思っている。
3月までに100万人分の提供体制構築完了、4月以降は1,000万人分以上/年の生産予定
政府はこれについて、最終段階の治験完了前の実用化を可能とする「条件付き早期承認制度」の適用の検討に入った。
条件付き早期承認は、医療上の有用性は高いが、患者が少ないなどの理由から最終段階の治験の早期完了が難しい医薬品について、一定の安全性・有効性の確認と、実用化後のデータの追加提出などを条件に、治験の途中段階での申請・承認を認める既存の制度。
希少疾病やがん治療薬などを念頭に置いたものだが、厚生労働省は新型コロナの治療薬も対象となり得るとみている。
ーーー
塩野義製薬は経口投与の新型コロナウイルス感染症(COVID-19)治療薬(開発番号:S-217622)の国内第2/3相臨床試験を2021年9月27日に開始した。
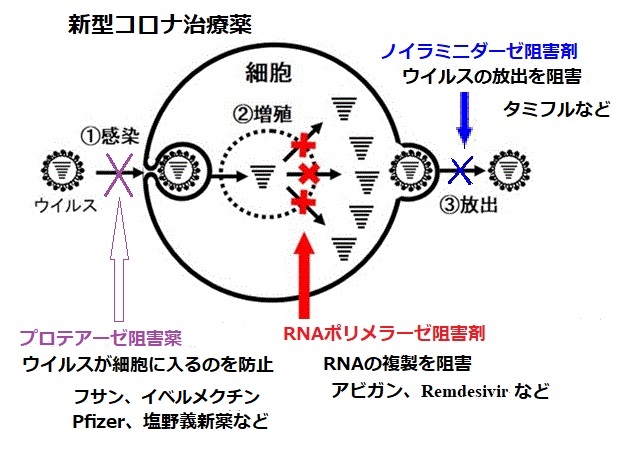
3CLプロテアーゼ阻害薬で、SARS-CoV-2の3CLプロテアーゼを選択的に阻害することで、SARS-CoV-2の増殖を抑制する。
2021/7/28 塩野義製薬、COVID-19治療薬の臨床試験開始
ーーーーーーーーーーーーーー
前日以前のブログを続けてみる場合は、ページトップのタイトル(下の部分)をクリックしてください。
過去のデータは下記から利用できます。
ブログ & データベース専用検索
COVID-19関連はここをクリック
コメントする