世界保健機関(WHO)は8月8日、過去最悪の感染となったエボラ出血熱が西アフリカの4カ国から拡大する恐れがあるとして、「国際的に懸念される公衆衛生上の緊急事態」を宣言した。
2013年12月にギニアで始まった感染は8月現在、ギニア、リベリア、ナイジェリア、シエラレオネで広がっており、患者は1,711人、うち死亡は932人となった。
発表 http://www.who.int/mediacentre/news/statements/2014/ebola-20140808/en/
渡航と貿易の全面禁止を勧告するまでに至らなかったが、感染者については公式な医療救助の対象とならない限り国境を越えるべきではないと指摘、当該国は航空各社と乗員への適切なケアを確実にするよう取り組むべきだとし、感染者と接した可能性のある乗客の確認を迅速にできるようにする必要があるとの見解を示した。
「ウイルスの毒性を考えれば、国際社会で感染がさらに広がった場合の結果はとりわけ深刻だ」とし、「エボラ出血熱の世界的な感染拡大を食い止め防止するためには、国際的な協調対応が不可欠だ」と指摘した。
エボラウイルスは大きさが80 - 800nmの細長いRNAウイルスで、自然宿主の特定には至ってはいないが、コウモリが有力とされている。
感染すると、発熱、悪寒、頭痛、筋肉痛、食欲不振などから、嘔吐、下痢、腹痛などを呈し、進行すると口腔、歯肉、結膜、鼻腔、皮膚、消化管など全身に出血、吐血、下血がみられ、死亡する。
現在のところ、エボラ出血熱ウイルスに対するワクチンはなく、有効かつ直接的な治療法は確立されていない。
ーーー
米政府機関はエボラ出血熱の治療に富士フィルムのインフルエンザ用治験薬ファビピラビル(favipiravir)を利用できるよう承認手続きを急いでいる。
米国防総省によれば、富士フイルムの米国での提携相手であるMediVector
Inc.はファビピラビルをエボラ出血熱感染者の治療に使えるよう申請する意向で、米食品医薬品局(FDA)と協議している。承認されれば、エボラ出血熱の感染者治療で米当局が承認する初の医薬品の一つとなる見通し。
今後、エボラ出血熱に感染したサルに同薬を投与して効果を確認する作業を進め、9月中旬には暫定的な試験結果を得られる見通しであるとされる。
ファビピラビルは既にインフルエンザ感染者の抗ウイルス剤として治験が重ねられており、エボラ出血熱の治療に適用する上で優位性がある。
現在はインフルエンザ治療薬として米国での治験の最終段階にある。
国防総省のJoint Project Manager
Transformational Medical Technologies (JPM-TMT) は2012年、
「軍関係者をインフルエンザの大流行から保護するため」、ファビピラビルの開発を後押しし、1億3850万ドルをMediVectorに助成している。
(Emerging
Infectious Diseases-Influenza Medical Countermeasures Acquisition
Program)
ーーー
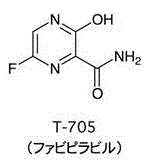
ファビピラビルは富士フイルム傘下の 富山化学の古田要介氏によって1998年に発見された。
インフルエンザウイルスは、感染した細胞内で遺伝子を複製し、増殖・放出することで他の細胞に感染を拡大する。
現在、治療に用いられている抗ウイルス剤はノイラミニダーゼ阻害剤(Neuraminidase
inhibitors)で、増殖されたウイルスの放出を阻害して感染の拡大を防ぐもの。
これに対し、ファビピラビル(製品名アビガン)は、ウイルスの細胞内での遺伝子複製を阻害することで増殖を防ぐRNAポリメラーゼ阻害剤である。
鳥インフルエンザウイルスA(H5N1)及び A(H7N9)等に対する抗ウイルス作用が期待されており、実験動物レベルでは既に効果が確認されている。
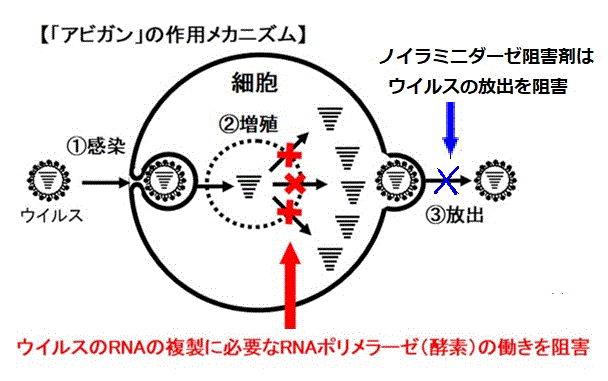
「アビガン」は、最近のインフルエンザを取り巻く現状をふまえ、新型又は再興型インフルエンザウイルス感染症が発生し、ノイラミニダーゼ阻害剤等の他の抗インフルエンザ薬が無効又は効果不十分である場合に備え、新しいメカニズム の「アビガン」を使用可能な状況にしておくことは意義があると判断され、世界に先駆けて国内で承認となった。直ちに医家向けに販売するのではなく、厚生労働大臣から要請を受けて製造・供給等を行うもので、新型又は再興型インフルエンザウイルス感染症が発生し、本剤を当該インフルエンザウイルスへの対策に使用すると国が判断した場合に、患者への投与が検討される。
付記 「アビガン®錠200mg」の承認には厳しい条件がついている。
・動物実験で「初期胚の致死及び催奇形性が確認されていることから、妊婦または妊娠している可能性のある婦人には投与しないこと」。
・日本人を対象にした薬物動態試験と追加臨床試験結果を医薬品医療機器総合機構に提出し、成績が確認されるまでは「原則製造禁止」 。
(申請に用いたのが米国の試験結果で、日本人を対象にしたものがなかった。)
但し、パンデミック時など厚労相が「要請」した際は製造できる。なお、追加試験で「季節性」インフルエンザに有効性が示されれば、富山化学は「季節性」の適応追加を申請することが可能になる。
米国では2007年3月より臨床試験を開始している。
2010年2月から臨床第Ⅱ相試験を開始した。A型あるいはB型のインフルエンザに感染した患者を対象に、高用量および低用量と偽薬(プラセボ)との二重盲検試験を実施し、好結果を得た。
2015年3月頃に第Ⅲ相試験の完了後に承認申請を行う予定。
コメントする