大日本住友製薬と創薬ベンチャーのサンバイオは近く、サンバイオが慢性脳梗塞治療剤として創製した細胞医薬品「SB623」の米国での臨床試験を開始する。
サンバイオが患者18人を対象に行った臨床試験フェーズ2aでは、脳梗塞の発症後 3年近く経過した患者でも運動機能の回復が見られた。
両社はフェーズ2bで、米国で治験に参加する患者を150人に増やし、詳細な効果や副作用を確認する。2018年から製品化前の最終治験を実施し、現地当局からの販売承認を目指す。
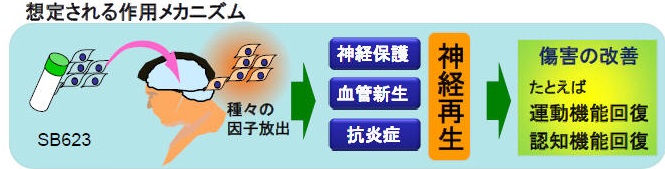
SB623は、健常人の骨髄由来の間葉系幹細胞を用いた、これまでにない全く新しい細胞医薬品である。
健常人から採取した骨髄液を加工・培養して作製された他家由来の細胞医薬品で、中枢神経細胞の再生を促すことによって、有効な治療法が存在しない慢性期脳梗塞への効果が期待され る。
また、他家由来細胞を利用して同一の製品を大量に作製できることから、自家由来細胞を用いる治療で必要となる医療機関等における個別の細胞調製などの処置が不要であり、多くの患者に均一な医薬品を提供することが可能とな る。
これまでの非臨床試験および臨床試験の結果では、慢性期脳梗塞に対して良好な効果を示すとともに、細胞医薬品で課題となっている副作用は認められていない。
大日本住友製薬は2014年9月26日に、「SB623」について、米国・カナダをテリトリーとした、共同開発および独占販売権のライセンス契約を締結した 。
大日本住友製薬はサンバイオに対して、契約一時金として6百万ドルを支払い、開発段階に応じた開発マイルストンとして合計80百万ドル(契約一時金を含む)を支払 う。
販売後は、サンバイオは大日本住友製薬に製品を供給し、大日本住友製薬は販売額に応じた2桁台の料率のロイヤリティを支払うとともに、年間販売額の目標達成に応じた販売マイルストンとして合計125百万ドルを支払う可能性があ る。
本剤の共同開発費用は両社で折半して負担する。
大日本住友製薬は、研究開発領域の一つとして、治療薬のない疾患分野および再生・細胞医薬分野に注力して いるが、脳梗塞による後遺症には治療薬がなく、アンメット・メディカル・ニーズの非常に高い疾患領域である。
なお、2010年2月に、帝人が「SB623」の日本における開発・販売に関する独占的なライセンス契約を締結し 、これを契機として、帝人グループ再生医療市場への本格的な参入を図っている。
ーーー
サンバイオは2001年2月に創業者2名によりカリフォルニア州で米国法人SanBio, Inc.として設立された。
事業として再生医療を選び、対象技術を選ぶなかで、岡野栄之慶應義塾大学教授 と出会った。
岡野教授は世界で初めて人の脳神経の元になる幹細胞を発見した医学者で、中枢神経系の細胞損傷の再生医療の研究で最先端を行っていた。
それまで再生は不可能だとされていた脳細胞を再生する夢のような技術で、脳梗塞の治療薬というかつてない製品開発につながる可能性がある。岡野教授はふたりに賛同し、教授の研究をもとにした医薬品を製品化することにSanBioの方向が定まった。
(岡野教授は現在、サンバイオの創業科学者:Founding Scientist となっている)しかし、岡野教授の技術では、将来、量産化の段階でアメリカの医学倫理規範に抵触するリスクが大きかったため、岡野教授のアドバイスで、東北大学の出澤真理教授の技術に変更した。
出澤教授の技術は同じ可能性のある細胞を成人の骨髄から得ることができるため、倫理面の問題もなく、材料の入手にも困らない。
さらに、「細胞のガン化リスク」もないというメリットがあった。これが、「SB623」に発展した。
2010年5月にSB623の脳梗塞用途でFDAからInvestigational New Drug Exemption (IND)の承認を取得、2011年1月に臨床試験フェーズ1/2を開始した。
2013年5月にはSB623の外傷性脳損傷用途のINDの承認も取得している。
2013年2月に日本法人サンバイオを設立、2014年1月に日米親子逆転の企業再編を実施、日本法人が米国法人の親会社となった。
コメントする