塩野義製薬は10月25日、同社創製の新規キャップ依存性エンドヌクレアーゼ阻害薬S-033188について、成人および小児におけるA型又はB型インフルエンザウイルス感染症を適応症として、日本国内における製造販売承認申請を行ったと発表した。
S-033188は、既存の薬剤とは異なる作用機序でインフルエンザウイルスの増殖を抑制する新規化合物であり、2015年10月に厚生労働省より先駆け審査指定制度の対象品目に指定されている。
先駆け審査指定制度は、2014年6月に厚労省が取りまとめた「先駆けパッケージ戦略」の重点施策や、「日本再興戦略」改訂2014を踏まえて導入したもの。
患者に世界で最先端の治療薬を最も早く提供することを目指し、一定の要件を満たす画期的な新薬等について、開発の比較的早期の段階から対象品目に指定し、薬事承認に係る相談・審査における優先的な取扱いの対象とするとともに、承認審査のスケジュールに沿って申請者における製造体制の整備や承認後円滑に医療現場に提供するための対応が十分になされることで、更なる迅速な実用化を図る。
原則として既承認薬と異なる作用機序により、生命に重大な影響がある重篤な疾患等に対して、極めて高い有効性が期待される医薬品を指定する。
審査期間をこれまでの半分の6ヶ月まで短縮することを目指す。
ーーー
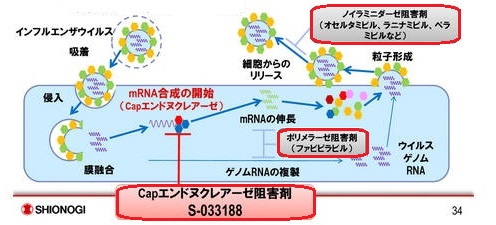
現在、治療に用いられている抗ウイルス剤はノイラミニダーゼ阻害剤(Neuraminidase inhibitors)で、増殖されたウイルスの放出を阻害して感染の拡大を防ぐもの。
オセルタミビル(oseltamivir) Roche 商品名 タミフル
ラニナミビル(Laninamivir) 第一三共 商品名 イナビル
ペラミビル (Peramivir) 米国 BioCryst Pharmaceuticals発症後48時間以内に服用しなければ効果が得られず、タミフルの場合は5日間程度服用を続ける必要がある。
エボラ出血熱の治療に使われた富士フィルムのファビピラビル(favipiravir)(商品名アビガン)は元々インフルエンザ用治験薬で、ウイルスの細胞内での遺伝子複製を阻害することで増殖を防ぐRNAポリメラーゼ阻害剤である。
これに対し、塩野義の新薬(S-033188)は、ウイルスが細胞に進入後、最初の反応となるmRNA合成の開始を特異的に阻害するCapエンドヌクレアーゼ阻害剤である。
ウイルスの増殖に必要なタンパク質が合成できなくなり、ウイルス粒子が形成されなくなる。
タミフルが5日間の服用が必要なのに対し、1回の服用で治療できる。
2015/11/6 塩野義製薬、インフルエンザ新薬を開発、1回投与で治療
S- 033188は、成人または小児を問わず、経口による1回のみの錠剤の服用で治療が完結するため、利便性が高く、確実なアドヒアランス(患者が積極的に治療方針の決定に参加し、その決定に従って治療を受けること)が期待できる。
これまで に実施した健常なインフルエンザ患者を対象とした臨床試験では、既存薬の タミフル®と比較して、抗ウイルス効果が高く、投与翌日には50%以上の 患者(小児を含む)でウイルス力価(感染性を有するインフルエンザウイルス粒子の指標)の陰性化が認められている。
そのため、家庭内や学校、職場等でのウイルス伝播、飛沫/空気感染拡大に対しても一定の抑制効果を示すことが期待される。
また、副作用の発現率がタミフル®と比較して有意に低く、 従来の治療と同等以上の安全性を示すと考えられる。
なお現在、 重症化、合併症を起こしやすいリスク因子を持つハイリスク患者を対象とした臨床試験を スイスのF. Hoffmann-La Roche との提携下、塩野義製薬が実施中。
塩野義製薬は2016年2月29日、S-033188の提携に関するライセンス契約を Roche との間で締結したと発表した。
日本と台湾を除く全世界におけるS-033188の開発をRocheとの提携下で進める。(日本では、Roche が61.62%出資する中外製薬がタミフルを販売している。)
2016/3/2 塩野義製薬、新規インフルエンザ治療薬の開発でRocheと提携
コメントする