厚生労働省は2月20日、薬事・食品衛生審議会 再生医療等製品・生物由来技術部会を開催し、ノバルティスファーマの「キムリア点滴静注」(チサゲンレクルユーセル)を国内初のCAR-T細胞医療として正式承認すること、アンジェスの重症虚血肢治療用として承認申請した「コラテジェン筋注用」(ぺペルミノゲンペルプラスミド)を条件期限付き承認することをいずれも了承した。2019年3月中にも承認される見通し。
付記 いずれも3月26日に承認取得
▽キムリア点滴静注(一般的名称:チサゲンレクルユーセル、申請企業:ノバルティスファーマ)
「再発または難治性CD19陽性のB細胞性急性リンパ芽球性白血病(B-ALL)」と「再発または難治性びまん性大細胞型B細胞リンパ腫(DLBCL)」を効能・効果とする。
希少疾病用再生医療等製品。同省によると、推定される投与対象患者数はピーク時で年間250例程度。
再審査期間は10年。
ーーー
付記
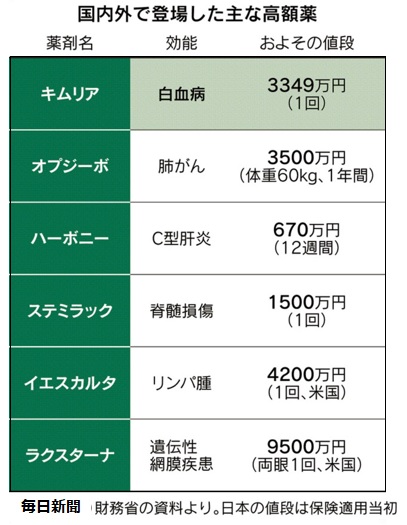
厚生労働省は5月15日、「キムリア」の保険適用を決めた。薬価を3349万円にし、5月22日から保険適用する。
治療対象は白血病の患者で抗がん剤が効かなかった人などに限定する。対象は216人と見込まれている。市場規模は72億円。
投与は1回で済む。ノバルティスの試験では、若年の白血病患者で8割に治療効果が見られた。
米国では約5200万円の価格がついたが、効き目に応じて患者から支払いを受ける成功報酬型が採用されている。日本では効果の有無に関係なく保険適用される。
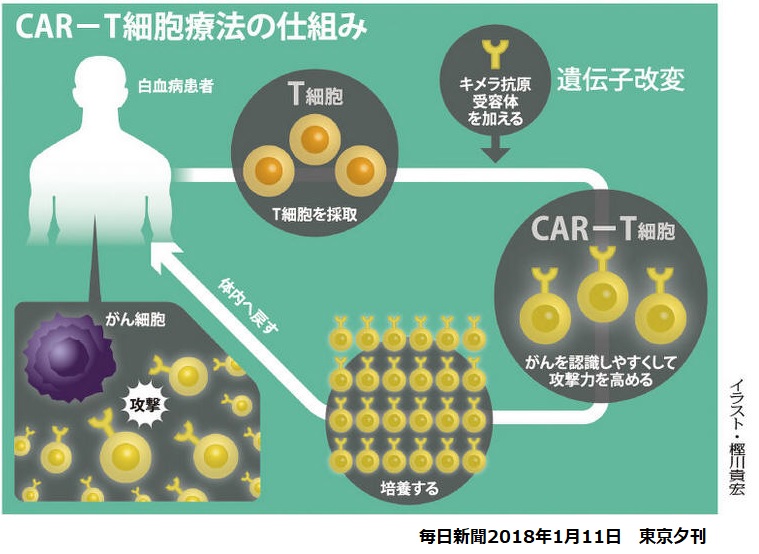
CAR-T細胞治療は、患者由来の免疫細胞(T細胞)の遺伝子組み換えを行い、がん細胞を捉えて攻撃しやすくした上で患者の体内に戻す免疫細胞医療で、治療法が確立していない重篤・致死的な疾患に対する治療法として期待されている。
患者からT細胞を採取し、 遺伝子操作により、キメラ抗原(CAR)受容体を発現させ、癌細胞を死滅させる治療法である。主作用が暴走すると重篤なサイトカイン放出症候群を引き起こすため、これを抑える「安全装置」の開発が成功のカギとされている。
承認条件として、製造販売後400例の症例に係るデータが集積されるまでの間は、全症例を対象に使用の成績に関する調査を実施することになった。その際には、データベース調査を実施する。
B-ALLとDLBCLでは用法・用量は異なるが、いずれも単回静脈投与。B-ALLでは通常、投与時に25歳以下の患者が対象。DLBCLでは通常、成人患者が対象となる。
米国で2017年8月30日、再発・難治性(r/r)B 細胞性急性リンパ芽球性白血病(ALL)の小児および若年成人患者を対象とするCAR-T療法の CTL019(商品名 Kymriah)が米FDAの承認を得た。
小児を含む25歳以下の再発・難治性B-ALLを適応症として、CAR-T細胞医療では世界初のFDA承認を取得したもので、治療は1回で済むが、475千ドル(約5200万円)と高額。同省では、国内の投与対象患者数は250例程度と予想している。
Medicare とMedicaid はこの処方に対し、Novartisに475千ドルを支払うこととなったが、1カ月末までに患者に効果があった時のみ、これを支払う。
ーーー
CAR-T細胞療法では日本では、第一三共が米国Gilead Scienceの大細胞型B細胞リンパ腫を対象に申請準備中であるほか、大塚製薬やセルジーンが開発を行っている。
米国のバイオテクノロジー企業 Gilead Sciences は2017年8月28日、がん治療のバイオテク企業 Kite Pharma を119億ドルで買収することで同社と合意した。
Kite Pharmaは、カリフォルニア州サンタモニカに本社を置き、体が持つ免疫システムを用いて抗腫瘍効果を得る癌免疫療法のリーダーである。
同社の最新のCAR-T療法と呼ばれる治療法では、患者からT細胞を採取し、 遺伝子操作により、B 細胞リンパ腫および白血病細胞表層に発現しているCD19 抗原を標的とするキメラ抗原(CAR)受容体を発現させ、癌細胞を死滅させる治療法である。
Kite PharmaはGilead Sciencesによる買収前の2017年1月9日、開発中のKTE-C19の日本における開発並びに商業化に関して、第一三共と戦略的提携契約を締結した。
第一三共は日本におけるKTE-C19 の開発ならびに商業化を行う。Kite は契約の一環として第一三共に技術供与を行い、更に第一三共はKITE-718 を含め、Kite が今後3年以内に米国にINDを提出するその他の開発候補品のライセンス権利を有する。
2017/9/1 米Gilead Sciences、がん治療のバイオテク企業 Kite Pharma を119億ドルで買収
ーーー
▽コラテジェン筋注用4mg」(一般的名称:ベペルミノゲン ペルプラスミド、 申請企業:アンジェス)
「標準的な薬物治療の効果が不十分で血行再建術の施行が困難な慢性動脈閉塞症(閉塞性動脈硬化症及びバージャー病)における潰瘍の改善」を効能・効果とする。
治験での評価症例数が少ないことから「条件及び期限付き承認」扱いとし、5年かけて対照群を設け 、製品群120例、対照群(標準療法)80例を比較評価し、有効性を改めて確認する。
閉塞性動脈硬化症は手や足の血管の動脈硬化により、狭窄(血管が狭くなる)や閉塞(血管が詰まる)を起こして、血液の流れが悪くなり、手先や足先へ栄養や酸素を十分に送り届けることができなくなる病気で、手足にさまざまな障害が現れる。
バージャー病とは、手足に栄養を供給するさまざまな動脈が、炎症により狭くなり、血液の流れが悪くなる病気で、 別名、「閉塞性血栓性血管炎(TAO)」とも呼ばれる。
これまでは外科的治療の施行が困難な患者には有効な治療手段がなかったが、血管がつまった足に、新たな血管を作る遺伝子を注射して治療する。
プラスミド(大腸菌などの細菌や酵母の核外に存在し、細胞分裂によって娘細胞へ引き継がれるDNA分子の総称)に、血管を新生する作用を持つHGF(肝細胞増殖因子)遺伝子を組み込み、それをベクターとして虚血部位に注射することで、細胞内で遺伝子が発現、血管新生が促され血流が確保されて潰瘍を改善するとされる。同省は、遺伝子治療用プラスミドベクター製品と位置づけている。
基本的には、成人に対し1か所あたり0.5mgを8か所に4週間間隔で2回筋肉内投与する。治験では、初回投与から12週間後の潰瘍完全閉鎖率は、閉塞性動脈硬化症では14例中7例(50%)バージャー病では10例中6例(60%)だった。
この製品は、重症虚血肢に十分知識・治療経験を持つ医師のもとで、創傷管理を複数診療科で連携して実施している施設で使用する条件が付された。
正式承認を経て薬価は5月にも決まるが、複数の関係者によると、治療費は1人200万~300万円になるよう設定されるとの見方がある。
アンジェスは大阪大学医学部の森下竜一助教授による研究成果を基に1999年に設立され、マザーズに2002年に上場した。設立時からコラテジェンの開発を手がけてきた。
開発品(2018/4時点の臨床開発ステージにある自社開発品の状況)
| プロジェクト | 開発コード 剤形 |
対象疾患 | 地域 | 開発ステージ・備考 |
| HGF遺伝子治療薬 (ベペルミノゲンペルプラスミド) |
AMG0001 注射剤 |
重症虚血肢 (閉塞性動脈硬化症 およびバージャー病) |
日本 | 今回、製造販売承認へ |
| 欧米 | 米国での試験計画を策定中 | |||
| NF-κBデコイオリゴ | AMG0101 軟膏剤 |
アトピー性皮膚炎 | 日本 | P3試験終了 (主要評価項目で有意差示されず) |
| AMG0101 注射剤 |
椎間板性腰痛症 | 米国 | P1b試験実施中 | |
| DNAワクチン | AGMG0201 注射剤 |
高血圧 | 豪州 | P1/2試験実施中 |
アンジェスは2月12日、重症虚血肢を対象とした HGF遺伝子治療薬のイスラエルを対象国とした独占的販売権許諾に関する基本合意書をイスラエルの Kamada 社と締結した。
イスラエルにおいて薬事承認及び保険償還が承認された場合に、一時金として最大 125 万ドル受領し、また発売後の累積売上及び年間売上に応じた一時金として最大 285 万ドル及び製品供給による売上を得る。
既に重症虚血肢を含む末梢性血管疾患を対象とした HGF 遺伝子治療薬の販売に関し、国内及び米国における独占的販売契約を田辺三菱製薬と締結している。
コメントする