第一三共は3月29日、抗がん剤でAstraZenecaと戦略的提携すると発表した。
同社が保有する抗体薬物複合体(antibody drug conjugate: ADC) のトラスツズマブ デルクステカン([fam-] trastuzumab deruxtecan)について、乳がん、胃がん、非小細胞肺がん及び大腸がんを含むHER2発現がんを対象としたグローバルな開発及び商業化契約を締結した。
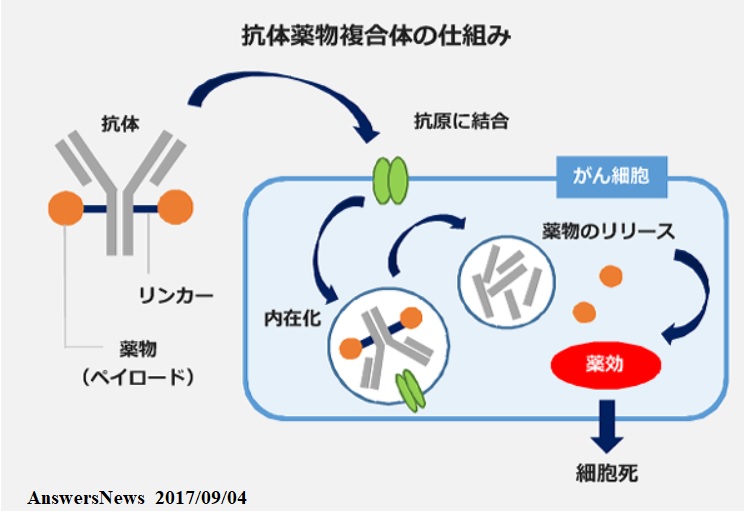
抗体薬物複合体(ADC)は、抗体と薬物(低分子化合物)を適切なリンカーを介して結合させた薬剤で、がん細胞に発現している標的因子に結合する抗体を介して薬物をがん細胞へ直接届けることで、薬物の全身曝露を抑えつつがん細胞への攻撃力を高め る。
本剤は、独自のリンカーを介して新規のトポイソメラーゼI 阻害剤(薬物)を抗HER2抗体に結合させた薬剤。抗HER2抗体とリンカー、ペイロード(トポイソメラーゼI 阻害剤)のすべてを自社技術で構築した。
トポイソメラーゼI 阻害剤は、癌細胞のDNAの2重らせん構造のうち1本を切断し、異常な細胞増殖を抑えることでがん細胞を殺す。
乳がんなどには、細胞の表面に、がん細胞に「増殖しろ」という指令を出す「HER2タンパク」をもっているものがあるが、トラスツズマブは、HER2タンパクの働きをブロックし,がん細胞の増殖を抑える 。
本剤は、まだ承認されていない治験薬で、安全性及び有効性は確定していない。
北米、欧州及び日本を含むアジアにおいて、本剤を用いた広範かつ包括的な臨床試験が進行中。
米国食品医薬品局(FDA)より、HER2陽性の再発・転移性乳がん治療を対象として画期的治療薬(Breakthrough Therapy)指定及びファストトラック指定を受けている。
付記
第一三共とアストラゼネカは12月23日、ENHERTU®(トラスツズマブ デルクステカン)について、米国食品医薬品局より「転移性の乳がんに対する治療として2つ以上の抗HER2療法を受けたHER2陽性の手術不能又は転移性乳がん」を適応として販売承認を取得したと発表した。
また、HER2過剰発現の進行・再発胃がん治療を対象として厚生労働省より先駆け審査指定を受けている。
第一三共では、HER2陽性の再発・転移性乳がんを対象としたFDAへの承認申請目標時期を2020年として いたが、今回、2019年度前半に前倒しすることを決めた。
ーーー
両社は日本を除く全世界において、本剤の単剤療法及び併用療法を共同で開発し、商業化する。第一三共は本剤の製造及び供給に責任を持つ。
サイエンス・テクノロジーに強みを持つ第一三共と、がん領域のグローバル事業に豊富な経験とリソースを持つAstraZenecaとの戦略的提携により、様々なHER2発現がんにおける単剤療法及び併用療法でのトラスツズマブ デルクステカン (DS-8201)の価値を最大化する。
AstraZenecaのCEOは、「DS-8201は、HER2陽性乳がん及び胃がん治療に変革をもたらす新薬になり得ると考えています。また、HER2低発現乳がんにおけるファーストインクラスとして乳がん治療を再定義する可能性があります。さらに、本剤は、肺がんと大腸がんを含む他のHER2変異・HER2過剰発現がんにおいて、抗HER2療法の恩恵を受ける患者さんの対象を広げる可能性があります。他の疾患領域においても長期的に協業している第一三共と今回提携することを誇りに思います」と述べてい る。
日本を除く全世界での開発・販売等の費用と利益は両社で折半する。
売上計上は、日本、米国、及び第一三共が拠点を有する欧州及びその他地域の複数国では第一三共が、中国、豪州、カナダ、ロシア及びその他地域ではAstraZenecaが行う。
AstraZenekaは第一三共に下記の対価を支払う。
契約一時金 13.5億米ドル 開発マイルストン達成等で 最大 38億米ドル 販売マイルストン達成で 最大 17.5億米ドル 支払総額 最大 69億米ドル
コメントする