科学技術省生物センター主任は、国内の2つの医療機関が行った臨床研究の結果、治療効果が認められ、明らかな副作用もみられなかったと述べた。
臨床研究は、湖北省武漢と広東省深圳の医療機関が、それぞれ240人と80人の患者を対象に行い、このうち深圳では「アビガン」を投与しなかった場合は、ウイルス検査の結果が陽性から陰性になる日数の中央値が11日だったのに対し、投与した患者では4日だった。
また、エックス線の画像で肺炎の症状の改善が認められた患者の割合は、「アビガン」を投与した場合は91%で、投与しなかった場合の62%より高かった。
付記
深圳の例は南方科技大学などのチームの論文で、アビガン投与の患者35人と抗HIV薬投与の患者45人の比較だが、この論文が取り下げられたことが判明した。
主任は「安全性が高く、効果も明らかで正式に推薦する」と述べ、治療薬の1つとして医療現場で使用を勧めていく方針を明らかにした。
下記の通り、中国では富士フィルムからライセンスを受けた浙江海正薬業股份が本年2月に中国政府から承認を受け、生産を開始している。
ーーー
富士フィルム子会社の富山化学(2018年10月に富士フイルムRIファーマと統合し、富士フイルム富山化学)は抗インフルエンザウイルス薬「アビガン®錠200mg」(Favipiravir) を開発した。
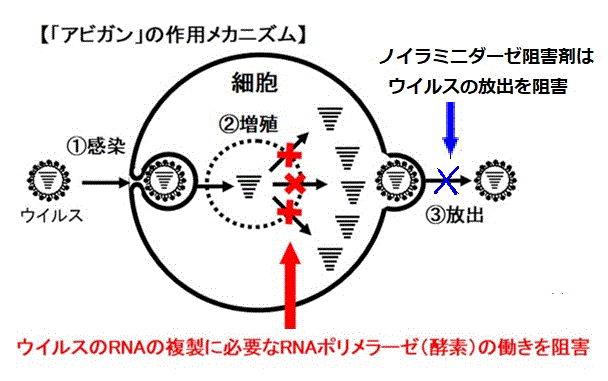
現在、治療に用いられている抗ウイルス剤はノイラミニダーゼ阻害剤(Neuraminidase inhibitors)で、増殖されたウイルスの放出を阻害して感染の拡大を防ぐものだが、アビガンは、ウイルスの細胞内での遺伝子複製を阻害することで増殖を防ぐRNAポリメラーゼ阻害剤である。
富山化学は2014年3月24日、日本で錠剤タイプの新しい抗インフルエンザウイルス薬「アビガン®錠200mg」の製造販売承認を取得した。
アビガンは、新型又は再興型インフルエンザウイルス感染症が発生し、既存の抗インフルエンザ薬が無効又は効果不十分である場合に備え、新しいメカニズムのアビガンを使用可能な状況にしておくことは意義があると判断され、世界に先駆けて国内で承認となった。
直ちに医家向けに販売するのではなく、厚生労働大臣から要請を受けて製造・供給等を行うもので、新型又は再興型インフルエンザウイルス感染症が発生し、本剤を当該インフルエンザウイルスへの対策に使用すると国が判断した場合に、患者への投与が検討される。
承認には次のような厳しい条件がついている。
・動物実験で初期胚の致死及び催奇形性が確認されていることから、妊婦または妊娠している可能性のある婦人には投与しないこと。
・日本人を対象にした薬物動態試験と追加臨床試験結果を医薬品医療機器総合機構に提出し、成績が確認されるまでは「原則製造禁止」 。(申請に用いたのが米国の試験結果で、日本人を対象にしたものがなかった。)
但し、パンデミック時など厚労相が「要請」した際は製造できる。
付記 富士フィルムは新型インフルエンザ流行に備えた国家備蓄用に200万人分を約68億円で納入している。
ーーー
富士フイルムは2016年6月22日、「アビガン」の有効成分「ファビピラビル」に関する特許ライセンス契約を、中国大手製薬会社の浙江海正薬業股份と締結した。
抗インフルエンザウイルス薬の開発・製造・販売を中国で行う権利を同社に対して許諾した。
海正薬業は、抗がん剤や抗生物質などの原薬や医薬品の研究開発・生産・販売を行う中国大手の製薬会社で、世界70以上の国・地域でビジネスを展開している。
富士フイルムは2018年10月25日、この浙江海正薬業と中日友好医院、 国家緊急防控薬物工程技術研究中心(National Engineering Research Center for the Emergency Drug)との間で、中国における抗インフルエンザウイルス薬の臨床開発に関する覚書を締結した。
- 富士フイルムは、これまで蓄積してきた「アビガン」の臨床データなどを、海正薬業や中日友好医院、NERCEDへ提供。
- 中日友好医院とNERCEDは、「アビガン」の有効成分を用いて、重症インフルエンザ患者を対象とした臨床開発を実施。
- 海正薬業は、中国において、「アビガン」と同一の有効成分を有する抗インフルエンザウイルス薬の製造販売承認の取得を目指す。
- 富士フイルムと海正薬業は、「アビガン」の有効成分を用いて、重症インフルエンザ患者などを対象とした注射剤の開発を検討。
海正薬業は本年2月に中国当局から生産認可を取得し、2月16日から「法維拉韋(ファビピラビル)」の商品名で生産を始めた。
付記 その後、中国で特許が切れ、ライセンス契約は2019年に終了。富士フィルムにライセンス料は入らない。
中国科学技術部の2月15日の発表によると、ファビピラビルは現在、新型肺炎の治療の臨床試験で使われている薬3種のうちの一つで、比較的高い治療効果と副作用が少ないことを示しているとされた。残りの2種は「リン酸クロロキン」(抗マラリア薬)と「瑞德西韋(レムデシビル)」(Gilead Sciences の製品)。
米国立衛生研究所(NIH)は、COVID-19の治療薬候補のGilead Sciences 社のRemdesivirの世界規模での治験に着手する。世界50カ所で偽薬とremdesivir を患者に投与し、治療効果を検証する。治験参加数は400人程度を想定しており、既に募集を始めた。
WHOを中心とした研究開発チームが抗エイズウイルス(HIV)薬のLopinavirとRitonavir の合剤と、Gilead Sciencesが開発した抗ウイルス薬 Remdesivir を試験している。
2020/2/22 COVID-19、WHOが2つの治療法試験ーーー 3週間以内に結果判明
中国を視察しているWHOのBruce Aylward 事務局長補は2月24日、「現時点で有効と思われる唯一の薬がある。それは remdesivirだ」と述べた。
付記 Bayerは「リン酸クロロキン」(抗マラリア薬)300万錠を米国政府に寄付した。マラリア用などで米国で承認を受けているが、新型コロナウイルス用に緊急使用の申請をしている。
コメントする