化学反応は高温ほど速く進むというのが一般的である。アレニウスの法則(Arrhenius equation)とよばれる。
スウェーデンの科学者Svante Arrheniusが1884年に、ある温度での化学反応の速度を予測する式を考えた。
窒素と水素からアンモニアを作るハーバーボッシュ反応は、400℃ 程度の高温と250気圧程度の高圧が必要である。
早稲田大学の研究グループは3月13日、外部から固体触媒に電位を与えることで、低温で化学反応が速く進む手法を世界で初めて発見したと発表した。
この研究は科学技術振興機構の支援で行なわれた。
研究グループは、触媒として1%のルテニウムを坦持した酸化セリウム半導体を使った。
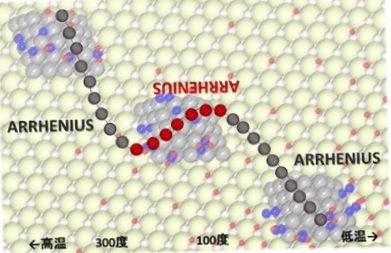
水素と窒素からアンモニアをつくる反応が、半導体性を有する固体触媒に 電圧をかけて6ミリアンペアの電流を流すと、200℃以下の低温でも速やかに進むこと 、特に100~200度では温度が低いほど反応が速くなる現象を発見した。
100℃以下と200℃以上では、アレニウスの法則通り、高温ほど反応が速かった。
(電圧をかけないと、温度が下がると反応は直線で遅くなった。)
赤線部分が非アレニウス領域(温度を下げたほうが反応速度が速くなる)
触媒の表面にイオン化した物質がくっつくと反応が活発になることが知られているが、低温だと反応速度は遅くなるものの、吸着が多くなって反応速度が速くなるというメカニズムが明らかになった。
これは、化学反応速度がアレニウスの法則に従うという過去の常識を打ち破るものである。
本研究成果は、2020年3月13日にイギリス王立化学会のジャーナル「Chemical Communications」のオンライン版で公開された。
https://pubs.rsc.org/en/content/articlelanding/2020/CC/D0CC00482K#!divAbstract
室温などの低い温度で物質変換が可能になるという、化学反応の世界にパラダイムシフトをもたらすものになる。
このようなメカニズムで反応が進む例はまだ限られている が、アンモニアだけでなく、別の化学反応にも応用できそうで、「これまでは排熱として捨てられ、あまり使われていなかった温度帯でも高い反応速度を出せれば、エネルギーの有効活用につながる」としている。
再生可能エネルギーを生かして、エネルギーや物質を創り出す多様な反応を、低温で選択的に進められるような材料を探索し、展開を進めていく。
コメントする