国立研究開発法人量子科学技術研究開発機構の平野俊夫理事長は4月15日、北海道大学遺伝子病制御研究所の村上正晃教授と共同で、新型コロナウイルスに関する論文を発表した。
COVID-19で肺炎を起こしても軽い症状で治る場合もあるが、重篤化する人もいる。特に重症化したCOVID-19に発症する急性呼吸器不全は致死率が高い。
この原因は免疫系の過剰な生体防御反応のサイトカインストームが原因であることを見付けた。
論文はImmunity に掲載された。COVID-19: A New Virus, but a Familiar Receptor and Cytokine Release Syndrome
論文のポイント:
- COVID-19に伴う致死的な急性呼吸器不全症候群(ARDS: Acute Respiratory Distress Syndrome)は、免疫系の過剰な生体防御反応であるサイトカインストームが原因であると考えられる。
- サイトカインストームは、遺伝子の転写因子であるNF-kBとSTAT3の協調作用により、免疫関連タンパク質であるインターロイキン6(IL-6)の増幅回路(IL-6アンプ)が活性化され、炎症性サイトカインの産生が異常に増加し起こる。
- COVID-19にみられる急性呼吸器不全症候群の治療薬の標的としてIL-6 アンプが有望であり、IL-6-STAT3経路の阻害が有効である。
すでに遺伝子導入T細胞(CAR-T)療法におけるサイトカイン放出症候群の治療に使用されており、かつIL-6アンプを阻害できる抗IL-6受容体抗体 も有望である。
最近のNature と Cell の論文で下記の点が明らかになっている。
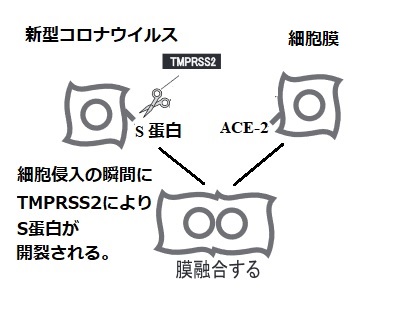
1)SARS-CoV-2ウイルスの表面に存在するスパイクタンパクは、細胞表面のACE2を受容体として結合するが、細胞内に入って感染するためにはスパイクタンパクが細胞表面のタンパク分解酵素であるTMPRSS2により切断・分割 (開裂活性化) される必要がある。
2)その後切断・分割され活性化したスパイクタンパクがウイルス膜と細胞膜の融合を引き起こす結果、ウイルスはACE2とともに細胞内に取り込まれる。
3)TMPRSS2の阻害剤はウイルス感染モデル実験系においてウイルスの細胞内取り込みを阻止した。またACE2に対する抗体もウイルスの細胞内取り込みを阻止した。
したがって、SARS-CoV-2ウイルスとACE2との結合を抑制する分子や、TMPRSS2の阻害剤はウイルス感染を抑制する効果が期待され、ウイルス感染の初期には有効な治療薬になる可能性がある。
また、スパイクタンパクに対する抗体、スパイクタンパク以外のウイルス膜タンパクに対する抗体やサーズウイルスや新型コロナウイルスから治癒した患者に存在する抗体なども期待される。
一方、感染後期に生じる致死的な急性呼吸器不全ARDSは、ウイルスが減少し始めた頃に生じる 。
筆者らは、これを、ウイルスそのものによるものではないと考え、過剰な生体反応であるサイトカインストームにより引き起こされるサイトカインリリース症候群CRSである とする。
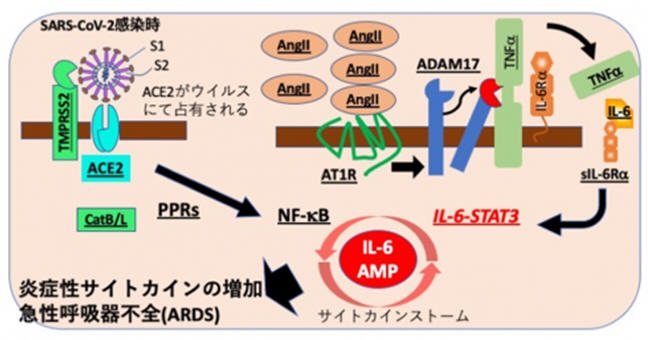
気管支・気道上皮細胞にてACE2に結合したSARS-CoV-2ウイルスは、TMPRSS2の作用により細胞内に取り込まれる。
転写因子であるNF-kBとSTAT3の協調作用により、インターロイキン6(IL-6)の増幅回路(IL-6アンプ)が活性化され、炎症性サイトカインの産生が異常に増加するサイトカインストームが発生することによりが発症するという仕組みを提唱した。
NF-kB は炎症反応で中心的な役割を果たす転写因子で、病気を引き起こすような過剰な活性化は、NF-kB活性化と同時にIL-6-STAT3経路の活性化が必要である。
STAT3 (Signal Transducer and Activator of Transcription 3) は転写因子であり核内で機能する。炎症時のSTAT3活性化因子はIL-6で、核内でNF-kBと会合してNF-kBの活性を増強する。
SARS-CoV-2ウイルスが細胞内に取り込まれると、ウイルス分子の構造を認識した細胞のパターン認識受容体(PPRs)が活性化し、下流のNF-kB経路が活性化する。さらに、感染に伴って本来ACE2に結合して分解されるアンジオテンシン(AngII)が血中に増加し、アンジオテンシン受容体1(AT1R)からの信号が過剰となる。
活性化されたAT1R信号は、蛋白質分解酵素であるADAM17を活性化し、細胞膜型のTNFa、IL-6Ra、増殖因子などの炎症関連分子を可溶性のものに変換する。
可溶性の炎症関連分子(図ではsIL-6Ra)は、気管支・肺胞上皮細胞、血管内皮細胞を含む非免疫系細胞にてNF-kBとIL-6-STAT3を同時に活性化し、IL-6アンプを活性化、これらの細胞の局所にて過剰なサイトカインが産生される。その結果、サイトカインリリース症候群CRSが引き起こされ、COVID-19にみられる致死的な急性呼吸器不全症候群ARDSが発症すると考えられる 。
感染初期は免疫力を高める必要があるが、重篤化すると逆に免疫を抑える治療が必要になる。
感染後期に見られる致死的な急性呼吸器不全症候群の治療には、すでに遺伝子導入T細胞(CAR-T)療法におけるサイトカイン放出症候群の治療に使用されており、かつIL-6アンプを阻害できる抗IL-6受容体抗体 も有望である。
有望視されるのが、中外製薬のIL6 阻害薬「アクテムラ」 (ヒト化抗ヒトIL-6レセプターモノクローナル抗体)で、関節リウマチ, 若年性特発性関節炎, 成人スチル病, 高安動脈炎・巨細胞性動脈炎, キャッスルマン病の治療に使われている。
中外製薬の親会社のRocheは3月19日、米国食品医薬品局(FDA)と連携し、重症COVID-19肺炎による入院患者を対象にActemra/RoActemraの第III相臨床試験を開始すると発表した。
Actemra/RoActemraについては、3月3日に中国国家衛生健康委員会(NHC)が発行したCOVID-19診断・治療計画第7版で言及されているが、安全性、有効性を確認する。
中外製薬は4月8日、「アクテムラ®点滴静注用80 mg、同200 mg、同400 mg」[一般名:トシリズマブ(遺伝子組換え)]について、COVID-19肺炎を対象とした国内第III相臨床試験を実施すると発表した。
付記
エーザイは7月1日、同社のTLR4(Toll-Like Receptor 4)拮抗剤エリトランが新型コロナウイルスのサイトカインストームを抑制の候補として臨床試験に入ると発表した。
カリフォルニア州のGlobal Coalition for Adaptive Researchとエーザイが、University of Pittsburgh Medical Centerと共同で臨床試験に入る。今後、日本を含む各国に拡大する。
エリトランは、細菌の感染に対する過剰炎症反応である重症敗血症の治療剤で、エーザイが創製したエンドトキシン拮抗剤。
細菌から放出されたエンドトキシンがその受容体であるTLR4に結合することを阻害することにより、TLR4が活性化すると引き起こされる受容体シグナルの伝達を防ぐ。その結果、炎症性サイトカインの遊離が阻害され、敗血症症状の発現が抑制される。
エリトランの安全性プロファイルは、重症セプシスを対象として実施した大規模な臨床第Ⅲ相試験で確認されている。
コメントする