|
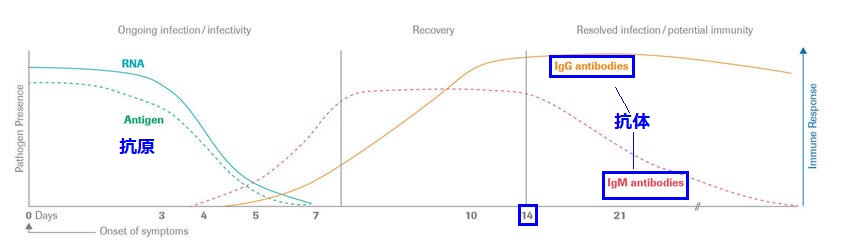
スイス製薬大手Rocheは5月3日、新型コロナウイルスの抗体検査薬 Elecsys® Anti-SARS-CoV-2 について米食品医薬品局(FDA)から緊急使用許可(Emergency Use Authorization :EUA) を取得したと発表した。 今月中にも欧米で数千万回分を提供する。日本でも5月中に承認申請する。 ドイツ政府は5月に300万個、それ以降は月500万個購入する契約を締結した。 なお、WHOは4月24日のScientific Brief で、抗体の存在を"immunity passport" や "risk-free certificate" とする向きがあるが、今のところ抗体を得た人が再度罹らないとの科学的根拠はないと注意を促している。
世界中の病院検査室ならびに検査会社において広く使用されているRocheの電気化学発光法免疫分析装置 コーバス(cobas e 411 analyzer, cobas e 601 / cobas e 602 modules, cobas e 801 module) によって検査することができる。
同社は約5200人について臨床試験を実施した。PCR検査で新型コロナの感染が確認された人について14日後に検査したところ、正しく陽性と判断する感度(sensitivity)が100%で、正しく陰性と判断する特異度(specificity)は99.8%超と信頼性が極めて高い。 簡易検査キットの場合、一般的な風邪の原因となるウイルスとコロナウイルスに対する抗体とを間違う可能性もあるが、Rocheのキットは新型コロナだけを高い精度で特定できるとされる。 Rocheは月間生産量を現在の5000万個から年末までに1億個以上に引き上げる。 |
米FDA、ロシュの新型コロナ抗体検査薬の緊急使用許可
検索
最近の記事
- 洋上風力第3ラウンド - 化学業界の話題
- 米議会、「つなぎ予算案」可決で政府機関の閉鎖回避 トランプ要求の「債務上限撤廃」を除外 - 化学業界の話題
- 米下院、つなぎ予算案を否決 - 化学業界の話題
- 米議会、国防権限法案を可決 - 化学業界の話題
- 米議会、つなぎ予算で攻防、トランプ次期大統領が介入 - 化学業界の話題
- 武田薬品とイスラエルのTEVA、JVの武田テバファーマを国内投資ファンドに売却 - 化学業界の話題
- 米大統領選挙の結果 - 化学業界の話題
- 「ブレイクスルー ノーベル賞科学者カタリン・カリコ自伝」 - 化学業界の話題
- Stellantisが英の1工場を閉鎖、英政府のゼロエミッション規制が負担 - 化学業界の話題
- 生体触媒を利用した資源循環可能なポリマー材料で、従来比8倍以上の強靭性、20倍の分解性・再利用性を達成 - 化学業界の話題
月別 アーカイブ
- 2024年12月 (8)
- 2024年11月 (9)
- 2024年10月 (13)
- 2024年9月 (14)
- 2024年8月 (10)
- 2024年7月 (17)
- 2024年6月 (27)
- 2024年5月 (24)
- 2024年4月 (26)
- 2024年3月 (23)
- 2024年2月 (20)
- 2024年1月 (19)
- 2023年12月 (21)
- 2023年11月 (22)
- 2023年10月 (23)
- 2023年9月 (14)
- 2023年8月 (22)
- 2023年7月 (21)
- 2023年6月 (21)
- 2023年5月 (23)
- 2023年4月 (20)
- 2023年3月 (22)
- 2023年2月 (19)
- 2023年1月 (24)
- 2022年12月 (29)
- 2022年11月 (25)
- 2022年10月 (24)
- 2022年9月 (27)
- 2022年8月 (23)
- 2022年7月 (25)
- 2022年6月 (33)
- 2022年5月 (27)
- 2022年4月 (25)
- 2022年3月 (36)
- 2022年2月 (26)
- 2022年1月 (28)
- 2021年12月 (32)
- 2021年11月 (31)
- 2021年10月 (34)
- 2021年9月 (31)
- 2021年8月 (28)
- 2021年7月 (31)
- 2021年6月 (33)
- 2021年5月 (39)
- 2021年4月 (35)
- 2021年3月 (36)
- 2021年2月 (32)
- 2021年1月 (55)
- 2020年12月 (44)
- 2020年11月 (34)
- 2020年10月 (48)
- 2020年9月 (43)
- 2020年8月 (43)
- 2020年7月 (41)
- 2020年6月 (48)
- 2020年5月 (39)
- 2020年4月 (39)
- 2020年3月 (39)
- 2020年2月 (32)
- 2020年1月 (31)
- 2019年12月 (35)
- 2019年11月 (33)
- 2019年10月 (37)
- 2019年9月 (33)
- 2019年8月 (38)
- 2019年7月 (37)
- 2019年6月 (36)
- 2019年5月 (43)
- 2019年4月 (36)
- 2019年3月 (44)
- 2019年2月 (29)
- 2019年1月 (31)
- 2018年12月 (32)
- 2018年11月 (32)
- 2018年10月 (29)
- 2018年9月 (28)
- 2018年8月 (29)
- 2018年7月 (40)
- 2018年6月 (36)
- 2018年5月 (37)
- 2018年4月 (34)
- 2018年3月 (34)
- 2018年2月 (27)
- 2018年1月 (26)
- 2017年12月 (29)
- 2017年11月 (32)
- 2017年10月 (28)
- 2017年9月 (32)
- 2017年8月 (33)
- 2017年7月 (34)
- 2017年6月 (31)
- 2017年5月 (31)
- 2017年4月 (32)
- 2017年3月 (31)
- 2017年2月 (26)
- 2017年1月 (26)
- 2016年12月 (35)
- 2016年11月 (28)
- 2016年10月 (35)
- 2016年9月 (30)
- 2016年8月 (31)
- 2016年7月 (33)
- 2016年6月 (34)
- 2016年5月 (27)
- 2016年4月 (28)
- 2016年3月 (28)
- 2016年2月 (26)
- 2016年1月 (28)
- 2015年12月 (38)
- 2015年11月 (30)
- 2015年10月 (31)
- 2015年9月 (27)
- 2015年8月 (30)
- 2015年7月 (29)
- 2015年6月 (32)
- 2015年5月 (29)
- 2015年4月 (35)
- 2015年3月 (31)
- 2015年2月 (25)
- 2015年1月 (26)
- 2014年12月 (33)
- 2014年11月 (32)
- 2014年10月 (28)
- 2014年9月 (27)
- 2014年8月 (31)
- 2014年7月 (29)
- 2014年6月 (26)
- 2014年5月 (28)
- 2014年4月 (27)
- 2014年3月 (30)
- 2014年2月 (25)
- 2014年1月 (24)
- 2013年12月 (29)
- 2013年11月 (27)
- 2013年10月 (29)
- 2013年9月 (25)
- 2013年8月 (30)
- 2013年7月 (32)
- 2013年6月 (30)
- 2013年5月 (28)
- 2013年4月 (32)
- 2013年3月 (32)
- 2013年2月 (25)
- 2013年1月 (33)
- 2012年12月 (33)
- 2012年11月 (26)
- 2012年10月 (31)
- 2012年9月 (27)
- 2012年8月 (31)
- 2012年7月 (30)
- 2012年6月 (18)
- 2012年5月 (35)
- 2012年4月 (31)
- 2012年3月 (31)
- 2012年2月 (31)
- 2012年1月 (40)
- 2011年12月 (32)
- 2011年11月 (30)
- 2011年10月 (32)
- 2011年9月 (26)
- 2011年8月 (41)
- 2011年7月 (37)
- 2011年6月 (27)
- 2011年5月 (34)
- 2011年4月 (28)
- 2011年3月 (31)
- 2011年2月 (32)
- 2011年1月 (30)
- 2010年12月 (31)
- 2010年11月 (31)
- 2010年10月 (36)
- 2010年9月 (35)
- 2010年8月 (33)
- 2010年7月 (33)
- 2010年6月 (32)
- 2010年5月 (28)
- 2010年4月 (32)
- 2010年3月 (32)
- 2010年2月 (25)
- 2010年1月 (31)
- 2009年12月 (31)
- 2009年11月 (32)
- 2009年10月 (30)
- 2009年9月 (28)
- 2009年8月 (34)
- 2009年7月 (33)
- 2009年6月 (28)
- 2009年5月 (36)
- 2009年4月 (35)
- 2009年3月 (31)
- 2009年2月 (36)
- 2009年1月 (34)
- 2008年12月 (31)
- 2008年11月 (31)
- 2008年10月 (34)
- 2008年9月 (32)
- 2008年8月 (24)
- 2008年7月 (29)
- 2008年6月 (26)
- 2008年5月 (24)
- 2008年4月 (28)
- 2008年3月 (28)
- 2008年2月 (27)
- 2008年1月 (28)
- 2007年12月 (30)
- 2007年11月 (27)
- 2007年10月 (34)
- 2007年9月 (27)
- 2007年8月 (25)
- 2007年7月 (29)
- 2007年6月 (27)
- 2007年5月 (29)
- 2007年4月 (28)
- 2007年3月 (27)
- 2007年2月 (24)
- 2007年1月 (25)
- 2006年12月 (26)
- 2006年11月 (26)
- 2006年10月 (27)
- 2006年9月 (26)
- 2006年8月 (21)
- 2006年7月 (30)
- 2006年6月 (26)
- 2006年5月 (26)
- 2006年4月 (30)
- 2006年3月 (33)
- 2006年2月 (15)
コメントする