水虫などの皮膚病用の飲み薬に睡眠導入剤が混入した問題で、福井県は2月9日、製造した小林化工に116日間の業務停止命令を出した。
付記
同社が設置した調査委員会は4月16日、「経営陣が違法な製造を認識しながら放置したのが根本原因」とする報告書を公表した。
厚労省は「同社に対し厳正な処分をする」と発表した。付記
厚生労働省は4月28日、小林化工に対し、医薬品医療機器等法に基づき、高脂血症治療薬・ロスバスタチン錠 「MEEK」など12品目の承認を取り消すと発表した。効力発生日は 2021 年6 月1 日。
あわせて業務改善命令を出し、5 月28 日までに是正措置及び再発防止策に係る改善計画を策定し、提出することを求めた。同法に基づく医薬品の承認取り消しは初めて。
付記
小林化工は2021年12月、サワイ製薬に後発薬の全工場と関連する部門の人員、物流や研究開発の拠点を譲渡
資産譲渡後、被害者への補償を最後まで責任を以って全うする。製造・販売してきた医薬品のうち、医療上必要不可欠な一部医薬品については、安定供給に支障を生じさせないよう他社への承継などを進める。
その他の医薬品については、全製品の自主回収および承認整理を行う。
問題となっている薬剤は経口抗真菌剤のイトラコナゾール錠50「MEEK」で、ロット番号T0EG08の製品。爪水虫やカンジダ症の治療に使われるジェネリック薬で、医師の処方箋が必要である。
この薬を処方された人が意識消失で転倒する、あるいは交通事故を起こす事例が続いた。
調べた結果、睡眠導入薬リルマザホンが混入されていたためと分かった。イトラコナゾール50mg 1錠あたりリルマザホン約5mgが混入されていた。
睡眠導入薬リルマザホンは本来 1錠2mgで、寝る前に1日1回1錠だけ飲む。
水虫の薬イトラコナゾール1錠50mgは、爪白癬に用いる場合、1日2回、1回4錠服用し、これを1週間続け、次の3週間は休薬。これを3サイクル繰り返す。
このため、本来1日2mgを飲む睡眠導入薬を本来の20倍の40mg (5mgを1日8錠)、これを1週間飲み続けたことになる。意識消失で転倒する、あるいは交通事故を起こすのは当然である。
2020年12月に2名が亡くなった。
2021年2月8日時点で、処方を受け、服用した人は324名で、健康被害が認められたのは239名に達する。
このうち、交通事故にあったのが22名、救急搬送・入院者が41名となっている。
小林化工の調査の結果、あわら市の本社工場で原料を量る担当の社員が、入れるべき成分と睡眠導入剤の成分「リルマザホン塩酸塩水和物」を取り違え、保管場所から持ち出したのが原因であった。本来は2人一組で確認が必要だったが、1人で作業していた。
4つのミスが重なった。
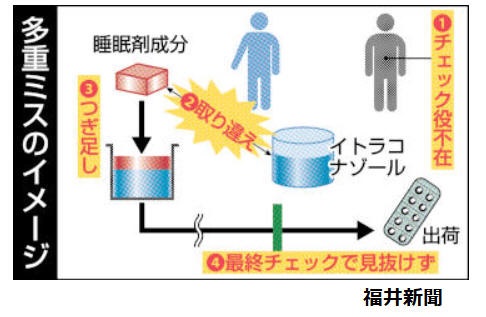
当時作業にあたったのは入社数年目の若手の男性従業員とされる。2020年7月ごろ、製造工程で本来の薬の主成分が減ったが、睡眠導入剤成分を足したことを示す製造記録が残っており、その記録を付けたのも、この従業員だという 。
原薬を継ぎ足すことは国が承認していないが、継ぎ足した。その際に、本来の薬と睡眠剤成分を取り違えた。
本来、2人で行う原薬の取り出し作業も、人員が不足していたために1人に任せていた 。このため、ダブルチェックが機能せず、取り違えに気が付かなかった。
更に、品質試験で異物の混入が疑われたにもかかわらず、原因を調査しないまま出荷していた。
法令違反としては、厚労省の承認外の手順による工程があったほか、立ち入り調査に備えて適切な工程を装った裏帳簿をつくったことや出荷前の品質検査で結果の捏造があった。
調査の結果、ほかの薬でも同様に承認外の手順書や裏帳簿が存在し、検査記録の捏造があった。品質検査で不合格となっても原因究明をしないまま合格するまで検査を重ねた違反もあった。
少なくとも2005年以降、約7割の製品で法令違反が確認された。
小林広幸社長ら経営陣も違法性を把握していたが、黙認し、改善を指示しなかった。
小林化工による薬の自主回収は、この4年間で5件目で、2019年10月には、胃潰瘍などの治療薬に発がん性物質が含まれていたことが判明した。
胃・十二指腸潰瘍などの治療薬「ラニチジン塩酸塩錠」について、中国で製造された原薬から許容限度値を超えた発がん性物質 N―ニトロソジメチルアミンが検出されたとの情報があったとして、約790万錠を自主回収すると発表した。
小林化工は2021年1月27日、22製品を自主回収すると発表した。厚労省や福井県などが12月に同社を立入調査した際に、全製品の調査を指示したもの。
調査の結果、現時点で不備が判明した製品の自主回収に踏み切った。
内訳は、
①参考品を試験したところ承認規格に不適合があった「10製品」、
②安定性モニタリングにおいて、承認規格に不適合またはモニタリングが未実施だった「11製品」(①に示した1製品含む)、
③製造工程の一部で承認書に記載されていない製造方法を行っていたもの「2製品」-となる。
ーーー
福井県は2月9日、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(医薬品医療機器等法)違反による業務停止命令と業務改善命令を出した。
業務停止処分は、承認外の手順で血液製剤を製造したとして厚労省が2016年に化学及血清療法研究所(熊本市)に対して出した110日間が最長だった が、これを上回る。
福井県は、製薬企業としての「法令遵守への意識の欠如」が主たる原因と強調 、経営層がこれら法令遵守を把握していながら改善策を講じなかったことが最大の問題だと断じた。
このほか睡眠導入剤混入医薬品以外にも、①承認内容と異なる医薬品の製造、②二重帳簿の作成、③品質試験結果のねつ造-などの法令違反が長年にわたり行われていたことが確認されたとも指摘している。
1)業務停止命令
(1) 第一種医薬品製造販売業(処方箋医薬品)に係る製造販売業務と、矢地工場の業務停止命令: 116日(2021年2月10日~2021年6月5日)
(2) 第二種医薬品製造販売業(処方箋医薬品以外)に係る製造販売業務と、清間工場業務停止命令:60日(2021年2月10日~2021年4月10日)
「事業再開時期については、追って提出される業務改善計画の内容を踏まえ、検討する」。
なお、福井県の了承を得た品目は、他社による製造販売および製造により安定供給に支障が無くなるまでの間に限り、業務停止命令から除外する。安全対策業務、製造設備の維持管理業務、製造管理および品質改善に係る業務についても除外される。
2)業務改善命令
(1) 医薬品医療機器等法に係る違反事項の原因究明及び改善を含め、関連法令を遵守するよう対応すること
(2) 再度の医薬品医療機器等法違反を起こさぬよう、
経営陣は役員として果たすべき責任について十分に自覚し、
法令遵守体制の抜本的な改革について早急に検討し、
それを実現するための組織体制を構築すること
理由
製造する製品について、承認書の製造方法と異なる製造を行っている製品があった、
虚偽の製造指図書、製造に関する記録、矢地工場においては品質試験に関する記録等を作成し、並びに製造管理及び品質管理の結果を適正に評価せずに出荷を行った、
製品の品質に大きな影響を及ぼす製造手順の変更時に変更管理がなされておらず、必要なバリデーションも適切に実施していなかった、製造手順等からの逸脱が生じた場合にその内容を記録しておらず、逸脱による製品の品質への影響の評価もせず、所要の措置をとらなかった、
医薬品製造管理者は、製造する製品について、承認書と製造実態が異なる事実や前述の事実を認識していたにもかかわらず、保健衛生上の支障を生ずるおそれがないように、その製造所に勤務する従事者等を適切に監督せず、必要な注意を怠った、
矢地工場において、承認事項と異なる成分、品質の医薬品及び異物が混入している医薬品を製造した、
福井県の薬事監視員が行った立入検査において、虚偽の報告を行った。
しかも経営トップが知っていながら黙認している。たった116日の業務停止でよいのだろうか。
付記
小林化工はジェネリック医薬品の大手。
日本ジェネリック製薬協会は2月9日、理事会において、会員会社の小林化工に対し、以下の理由により「除名」の措置を決定した。
1 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(薬機法)に対して重大な違反を犯したこと
2 多くの健康被害を発生させたこと
3 医薬品に対する信頼を揺るがし、当協会の信用を失墜させたこと
コメントする