付記Atea Pharmaceuticalsは10月19日、Rocheと共同で開発している経口治療薬「AT-527」について、中期段階の臨床試験(治験)で期待通りの有効性を確認できなかったと発表した。
治験では、重症化リスクが低い軽・中等症のコロナ患者らを中心に経口薬の有効性を調べたが、体内のウイルスを減少させる明確な効果は見られなかった。
基礎疾患があり、重症化リスクの高い患者らには一定の効き目があったという。これを受け、後期治験の見直しを検討する。
付記
Roche は11月16日、Atea Pharmaceuticalsとの「AT-527」に関する提携関係を解消すると発表した。
2022年2月で終了し、すべての権利をアテアに返還する。これにともない、ロシュと契約していた中外製薬の日本での事業化権利も返還対象になる見込み。中外製薬は12月16日、AT-527について、自社による開発を終了すると発表した。Ateaに引き継ぐ。
国は、国内治験の手続きなどを支援するため、中外製薬に4億5800万円の補助を決めて おり、承認申請を断念することで、補助金の一部は返金を求めることになるという。
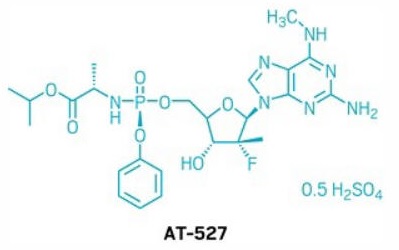
「AT-527」はAtea Pharmaceuticalsが創製したRNAポリメラーゼ阻害薬。
AT-527は、ヒトフラビウイルスやコロナウイルスを含む一本鎖RNAのゲノムを有する複数のエンベロープウイルス (タンパク質の殻であるカプシドが脂質性の膜であるエンベロープに包まれている)に対し、in vitroおよびin vivoで抗ウイルス活性を示すプリンヌクレオチドの経口プロドラッグで 、高い選択性を有し、RNAウイルスの複製に不可欠な酵素であるウイルスRNA依存性RNAポリメラーゼを特異的に阻害するように設計されてい る。
Atea は当初、C型肝炎ウイルス治療の経口薬として開発していた。経口薬という利便性の高さがポイントである。
同剤はCOVID-19に対する経口治療薬としての可能性が検討されており、現在、入院が必要な中等症患者と、入院していない軽症から中等症の患者を対象とした2本のP2試験を行っており、今年6月までPhaseⅢ試験に入る見込み 。
抗ウイルス活性および安全性は、C型肝炎患者を対象とした第II相臨床試験およびSARS-CoV-2ウイルスを対象とした非臨床in vitro試験で確認されてい る。
ワクチンはCOVID-19のパンデミックを緩和する上で重要な役割を果たすが、ウイルスの感染以前に注射する必要がある。直接作用型抗ウイルス薬はウイルス曝露前および曝露後の予防に使用される。
RocheとAteaは2020年10月22日、これに関する戦略的提携契約を締結した。同剤の 開発を共同で実施し、承認された場合は、米国での販売はAtea 、全世界での製造および米国外の販売はRocheが担 う。
Roche はAtea に対し、対価として350百万ドルを支払う。
今回のライセンス契約により、中外製薬は日本におけるAT-527に対する 独占的な開発権および 販売権を取得する。契約金など経済的条件は非開示。
コメントする