厚生労働省の薬事・食品衛生審議会医薬品第二部会は7月19日夜、中外製薬が申請した新型コロナウイルス向け治療薬「抗体カクテル療法」の製造販売承認を了承 、厚労省は同日、特例承認した。
国内のコロナ治療薬は4つ目で、主に軽症や中等症を対象とする国内で初めての薬になる。
今回の承認は、COVID-19患者を対象として海外で実施された第III相臨床試験の成績、および日本人における安全性と忍容性、薬物動態の評価を目的とした国内第I相臨床試験の成績に基づいている。
国内における供給は、日本政府との合意に基づき、2021年分が確保されている。
中外製薬は2021年5月10日、本抗体カクテル療法が日本において薬事承認された場合、国内での供給を目的として2021年分を日本政府が確保することで政府と合意した。
付記
菅義偉前首相は10月12日、新型コロナウイルスの軽症・中等症患者向けの抗体カクテル療法「ロナプリーブ」について、中外製薬から1回31万円で50万回分調達していたことを明らかにした。
厚生労働省によると、中外製薬との契約では、購入価格や数量は明らかにしない秘密保持の条項が含まれている。
付記
中外製薬は10月11日、抗SARS-CoV-2モノクローナル抗体「ロナプリーブ™」(カシリビマブ(遺伝子組換え)/イムデビマブ(遺伝子組換え)について、
① 新型コロナウイルス感染症(COVID-19)の予防および無症状の感染者の治療に対する適応拡大
② 静脈内投与(点滴)に加えて、皮下投与を可能にする用法追加
の申請を行なった。特例承認の適用を希望している。
ーーー
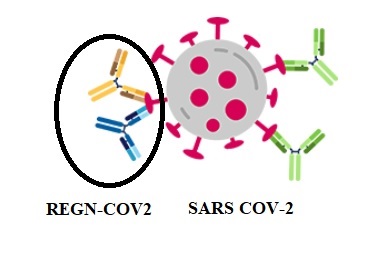
Regeneronの抗体カクテル「Casirivimab and Imdevimab Antibody Cocktail」(旧称 REGN-COV2)は、コロナウイルスのスパイクタンパク質に対する2つのモノクローナル抗体(REGN10933+REGN10987)を組み合わせたもの。
何千ものモノクローナル抗体候補のなかから最終的にウイルスに対する強い中和抗体を産出させることができる組み合わせを見つけた。
抗体はウイルスが健康な細胞に感染するのをブロックするが、単一の抗体の場合、ウイルスの自然発生的な変異型は、抗体のブロック作用を回避する可能性がある。これらの変異体は抗体処理にもかかわらず生き残り、増殖することができ、最終的にはウイルスの優性株になる可能性がある。
REGN-COV2は重複しない別々の場所でウイルスのスパイクタンパク質に結合することにより、ウイルスが逃げるリスクを減らすことができる可能性があることを示す。
米食品医薬品局(FDA)は2020年11月21日、Regeneron Pharmaceuticals, Inc.のCOVID-19の抗体カクテル療法「Casirivimab and Imdevimab Antibody Cocktail」について、緊急使用許可(EUA) を与えた。
トランプ前大統領は2020年10月2日未明、ツイッターで、「今夜、妻と私は新型コロナウイルスの陽性と判定された。直ちに隔離と回復のためのプロセスを開始する。この新型ウイルスをともに乗り越えていく」と投稿した。
大統領は10月2日、首都ワシントン郊外の米軍医療施設 Walter Reed National Military Medical Center に入院した。
トランプ米大統領の専属医は10月2日、新型コロナウイルス感染で入院した大統領が抗ウイルス薬Remdesivirを服用したと明らかにした。
また、米Regeneron Pharmaceuticals, Inc.の治験段階にある抗体カクテル療法が使用された。Regeneron Pharmaceuticalsは大統領の主治医から人道的見地で未承認薬の使用を認める「Compassionate Use」の要請を受け、大統領向けに高用量の未承認の抗体カクテル「REGN-COV2」1回分を提供した。医師団は大統領の容体の安定に向けてステロイド薬「デキサメタゾン」の使用を始めた。
トランプ前大統領は10月5日夕、退院した。
2020/10/4 トランプ大統領にレムデシビル投与、未承認の抗体カクテル療法も
RocheはRegeneron との間で、この製造および開発を共同で実施するとともに、米国での販売はRegeneron 、米国外での製造および販売をRohceが担う契約を締結している。
中外製薬は2020年12月10日、Rocheより新型コロナウイルス感染症(COVID-19)に対するこの抗体カクテル療法「REGN-COV2」について、日本における開発および販売に関するライセンス契約を締結した。
中外製薬は2021年6月29日、Casirivimab と Imdevimabの抗体カクテル療法について、COVID-19患者を対象とした海外第III相臨床試験成績、および日本人を対象とした国内第I相臨床試験成績に基づき、製造販売承認申請を厚生労働省に行った。
2020/11/24 FDA、Regeneron Pharmaceuticalsの抗体カクテル療法にEUA
海外の臨床試験(治験)では、入院はしていないが肥満や心血管の病気といった重症化リスクがある人でこの療法を受けた感染者は、受けていない感染者と比べて、入院ないし死亡するリスクが70%低かった。
感染者と同居している未感染の人を対象とした試験では、この療法を受けた人の方が、感染して発症するリスクが81%低かったという。
また、無症状の感染者が発症するリスクを31%抑えたことも確認された。
ーーー
医薬品医療機器等法第14条の3に基づく特例承認の概要は次の通り。
- 製品名:ロナプリーブ点滴静注セット300、同点滴静注セット1332
一般名:カシリビマブ(遺伝子組換え)及びイムデビマブ(遺伝子組換え)
対象:COVID-19の重症化リスク因子を有し、酸素投与を要しない患者。軽症から中等症に相当する。
重症化リスク因子:50歳以上の高齢者、基礎疾患のある人(慢性閉塞性肺疾患(COPD)、慢性腎臓病、糖尿病、高血圧、心血管疾患、肥満、喫煙)、一部の妊娠後期の人
点滴処理のため、入院患者への使用になる。厚労省は、自宅療養や宿泊療養も含めた療養者全体の十数%が投与対象になり得ると推計。
世界的にかなり需給がひっ迫しているため、確保量の兼ね合いもあり、対象を限定する。
用法及び用量:通常、成人及び12歳以上かつ体重40kg以上の小児には、カシリビマブ(遺伝子組換え)及びイムデビマブ(遺伝子組換え)としてそれぞれ600mgを併用により単回点滴静注する。
症状が発現してから速やかに投与
(臨床試験において、症状発現から8日目以降に投与を開始した患者における有効性を裏付けるデータは得られていない )
国が買い取り、医療機関に供与するため、薬価収載はされないが、海外の例から1回当たり20-30万円とされる。全額国家負担となる。
国の委託を受けて、中外製薬が医療機関からの希望を受け付けて7月20日から配送する。
なお、海外ではロナプリーブのCOVID-19発症予防効果に関する臨床試験が進行中だが、中外製薬は予防の効能効果での申請していない。
国内で承認されている新型コロナの治療薬としては4つ目となる。
1. レムデシビル:抗ウイルス薬(エボラ出血熱用に開発)
メーカー Gilead Sciences 対象 主に中等症や重症患者 承認 FDA 2020/5/1 EUA 日本 2020/5/7 特例承認 2020/5/1 レムデシビル、5月にも特例承認
2. デキサメタゾン:ステロイド剤(重度の肺炎・リウマチなどの薬)
メーカー (一般の抗炎症剤) 対象 主に中等症や重症患者 承認 英 2020/6/16 標準治療に 日本 2020/7 使用承認 2020/6/17 COVID-19 重症患者にステロイド剤デキサメタゾンが効果
3. バリシチニブ(オルミエント) :関節リウマチなどの薬
メーカー 日本イーライリリー 対象 主に中等症や重症患者 承認 FDA 2020/11/19 レムデシビルとの併用でEUA 日本 2021/4/27 使用承認 2021/4/23 厚労省、3つ目のコロナ治療薬承認
4. カシリビマブ / イムデビマブ:抗体カクテル療法
メーカー Regeneron、Roche / 中外製薬 対象 主に軽症や中等症患者 承認 FDA 2020/11/21 EUA 日本 2021/7/19特例承認
ーーー
・ アクテムラ :抗リウマチ薬
メーカー 中外製薬 Roche/Genentech 承認 FDA 2021/6 EUA 日本 年内申請 2021/6/28 中外製薬の抗リウマチ薬「アクテムラ」、FDAが新型コロナウイルス治療薬として緊急使用許可
・ AT-527:C型肝炎ウイルス治療の経口薬
メーカー Atea Pharmaceuticals Roche / 中外製薬 2021/2/25 中外製薬、Rocheから新型コロナの経口新薬候補導入
・ アビガン :抗インフルエンザウイルス薬
メーカー 富士フィルム 承認 日本 2020/12 継続審議 2020/12/22 厚労省審議会、アビガン承認見送り、継続審議
コメントする