FDAの委員会は10月26日、Pfizerの新型コロナウイルスワクチンの接種対象を5歳から11歳にも広げる案について議論を行い 、「接種の利益はリスクを上回る」とする結論を賛成多数で可決した。
専門家の委員会で、Pfizerは2200人以上の子どもを対象にした臨床試験の結果、新型コロナウイルスの感染症を防ぐ有効性は90.7%と高く、安全性にも懸念は示されなかったと説明した。
またFDAは、この年齢層について、さまざまな想定を分析した結果として「感染によって入院するリスクのほうが、ワクチン接種による副反応のリスクより高い」という見方を示した。
このあと委員会では、専門家による議論を踏まえて投票が行われ、委員の1人が棄権したほかは全員が「利益がリスクを上回る」とする結論について賛成し、可決した。
これを受けて、FDAは近く、接種の対象を拡大する緊急使用の許可を出すものと見られ、 正式に勧告されれば、11月上旬にも接種が始まる。
付記 FDAは10月29日、承認した。
付記 Pfizer は11月10日、厚労省に5~11歳に投与する承認申請を行った。
付記 厚生労働省は11月11日、3回目の接種について、18歳以上を対象にPfizer製ワクチンを使うことを特例承認した。
海外の治験で、中和抗体の値が3回目を接種した後は2回目と比べておよそ3.3倍に上昇した。
18歳未満については、現時点では、有効性や安全性を示すデータが十分ではないとしている。
委員会で多くの専門家が指摘したのが、ワクチンを接種した若い男性でまれに発症するとされる、心臓やその周りに炎症が起きる「心筋炎」や「心膜炎」のリスクについてで あった。
ワクチンの「副作用報告システム(Vaccine adverse event reporting system)」によると、心筋炎などの件数は、mRNA ワクチンのPfizer、Moderna ともに、ワクチンの2回目の接種後で、若い男性で非常に多い。
接種100万回当たり の件数は下記の通りで、若年層の場合(特に男性)で多い。これが、5歳から11歳にも広げる案で問題となった。
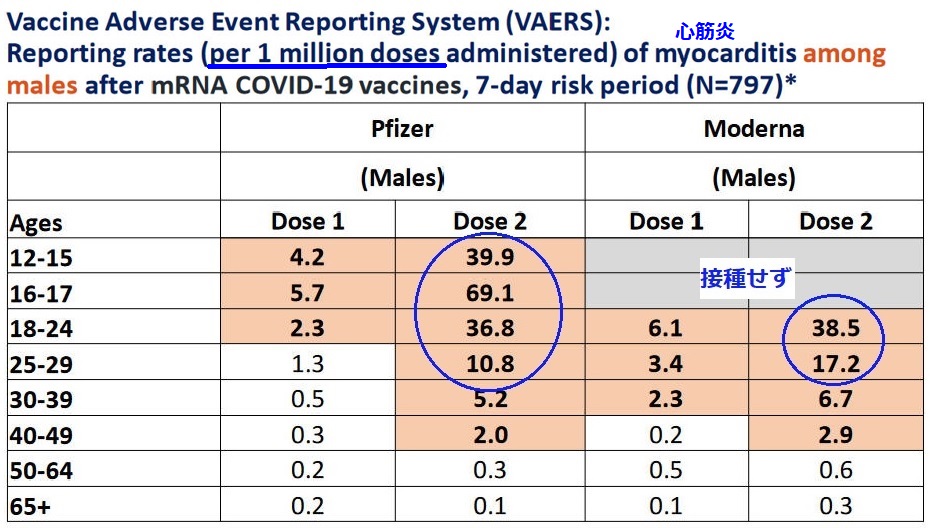
Pfizerが行った5歳から11歳の臨床試験では、これまでに心筋炎などの報告はないということ だが、臨床試験の対象人数が少なすぎるとしている。
FDAは、6つのシナリオでこの年代について接種の利益とリスクを比較した結果、ほとんどのシナリオでワクチンの接種によって防ぐことができると予測される感染や入院の件数は、心筋炎による入院の件数などを上回り、接種による利益が明らかだとしてい る。さらに、5歳から11歳の子どもは1回のワクチン接種量がほかの年代の3分の1に抑えられることなどから、心筋炎を発症するリスクは12歳から15歳に比べて低くなると考えるのが合理的だとしてい る。
Pfizerワクチンは米国で16歳以上について2020年12月11日にFDAから緊急使用許可を取り、2021年5月10日に12~15歳についても緊急使用許可を取った。2021年8月23日に正式承認を得たが、これは16歳以上である。
ーーー
一方 Modernaも、10月25日に同社のワクチンがKidCOVE studyと呼ぶ4753人を対象とした Phase 2/3 臨床試験で 6~11歳の子どもに対して安全で強力な免疫効果を示したことを明らかにした。
臨床試験に参加した子どもたちに、成人の量の半分である50マイクログラムのワクチンを28日間隔で2回にわたって投与した結果、若い成人と比べて1.5倍の抗体を生成した。
副反応は、そのほとんどが疲れ・頭痛・発熱・接種部位の痛みのような軽症・普通レベルの症状であった。 また、心筋炎のような稀な副反応の事例は、報告されなかった。
しかし、これについてはPfizerと同じく、臨床試験の対象人数が少なすぎると見る見方が多い。
Modernaワクチンは2020年12月17日に、18歳以上について緊急使用許可を取った。
2021年6月に12~17歳を対象とした緊急使用の承認を申請したが、まだ許可は下りていない状態である。
FDAは、まれな炎症性心疾患のリスクを高める可能性を評価するために若年層での承認判断を先送りしている。関係者によると、北欧の4カ国がModerna製ワクチンの若年層での接種に反対姿勢を強めたことを踏まえて、Pfizer製ワクチンとの比較で、Moderna製ワクチンを接種した若い男性が心筋炎を患うリスクを改めて調べているという。
上の表では、Moderna製ワクチンの患者が若干多い。
付記 Modernaワクチンの12~17歳を対象とした緊急使用の承認は来年1月以降になる見込み。
コメントする