バイオ企業のヘリオスが、新型コロナウイルス患者の死亡原因の一つである重症肺炎などに生じる呼吸不全を治療する新薬候補について、2021年内にも厚生労働省に製造販売承認を申請すると報じられた。最終段階の臨床試験(治験)で良好な結果を確認した。
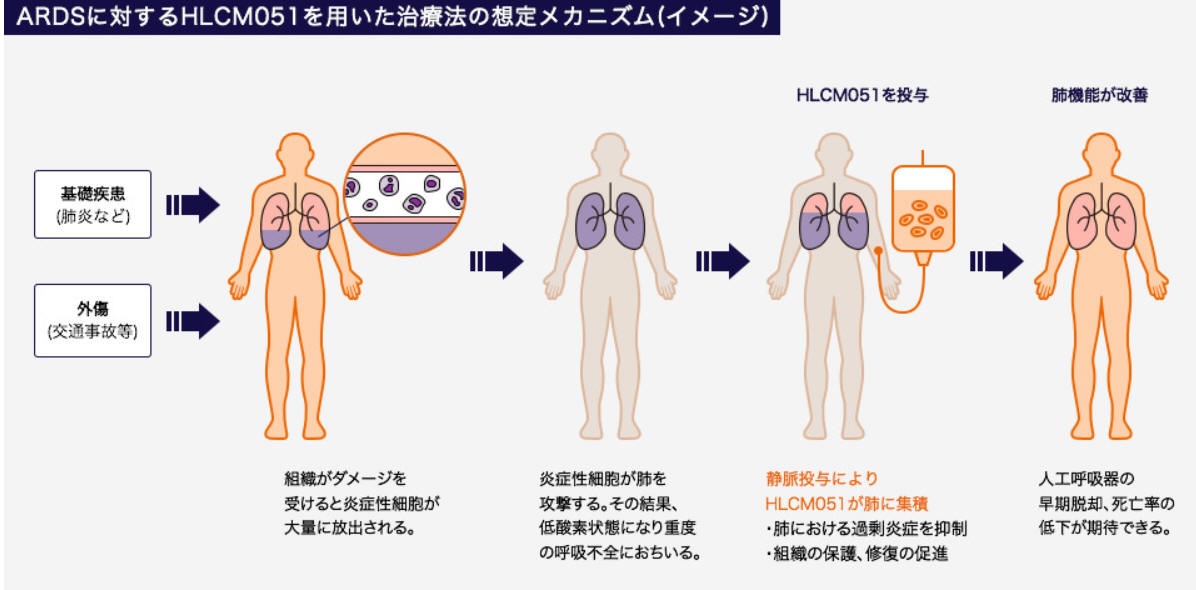
急性呼吸窮迫症候群(Acute Respiratory Distress Syndrome:ARDS)は、重症肺炎、敗血症や外傷などの様々な疾患が原因となり重度の呼吸不全となる症状の総称で、炎症性細胞が活性化され、肺の組織である肺胞や毛細血管に傷害を与える。その結果、肺に水がたまり、重度の呼吸不全が引き起こされる。
ARDSは一般的に、原因となる疾患や外傷が発生してから24~48時間以内に発生すると言われており、発症後の死亡率は全体の30~58%とされ、極めて予後が悪い疾患である。
ARDSに対する治療として、集中治療室で気管チューブやマスクを使った人工呼吸管理による呼吸不全に対する治療が行われるが、人工呼吸器の使用が長期化すると、患者の予後が悪くなる。
薬物療法も行われるが、現時点において、ARDSを発症した際の生命予後を直接改善できる治療薬はない。
体性幹細胞には、神経幹細胞、間葉系幹細胞、造血幹細胞など複数の種類があり、生体のさまざまな組織に存在する。Athersysの創製した幹細胞製品MultiStem®(HLCM051)は、ヒト骨髄由来の細胞製剤である。
ARDSを発症した患者に静脈投与されたHLCM051は、肺に集積して過剰炎症を抑制し、さらに損傷を受けた組織を保護し、修復を促進することで肺機能を改善すると考えられる。これらの作用により、人工呼吸器からの早期脱却、死亡率の低下などが期待されている。
Athersysの創製したHLCM051は、ヒト骨髄由来の細胞製剤で、凍結保存により長期保管が可能、免疫抑制剤が不要、静脈注射(点滴)で投与された細胞は体内へ蓄積することなく消失、といった特徴を有している。
ーーー
ヘリオス(Healios)は旧称 日本網膜研究所で、2011年に設立され、2013年9月に改称した。
Healiosは、Helios(太陽の神)とHeal(癒す)の二つの言葉から構成され、難治性疾患治療の新たな希望の光と、疾患に侵された患者様を癒していきたいという願いが込められている。
同社の事業の1つはiPSC再生医薬品事業で、iPS細胞を分化誘導して人体と近似の機能を持つ細胞を作製し、その細胞を移植する。
開発コード 対象 地域 開発段階 がん免疫 HLCN061 固形がん 日本・欧米 前臨床試験 遺伝子編集Natural Killer細胞を自社で開発 細胞置換 HLCR011 滲出型加齢黄斑変性 日本 同上 大日本住友製薬と共同開発 HLCR012 萎縮型加齢黄斑変性 欧米 同上 HLCL041 代謝性肝疾患 日本 同上
2013/12/4 大日本住友製薬と理研認定ベンチャーのヘリオス、iPS細胞由来医薬品を共同開発
もう一つの事業として、ヘリオスは米国のAthersys, Inc が創製した幹細胞製品MultiStem®(HLCM051)を用いた国内におけるARDSの治療法の開発・販売権を取得し、新規の細胞治療法を開発している。
Athersysは、人の寿命を延ばし、生活の質を向上させる治療薬候補品の探索や開発に注力する国際的なバイオテクノロジー企業で、開発中の MultiStem を用いた細胞治療医薬品は、特許取得済みの成人由来の量産可能な幹細胞製品である。
現在、心血管、神経、炎症、免疫系の疾患領域を適応症として複数の臨床試験を実施し再生医療製品としての評価を行っている。
Athersysは2020年4月に新型コロナウイルス感染症を起因とするARDS患者を対象とした第II/III相試験を開始した。
日本国内におけるMultiStem®を用いた脳梗塞の治療を目的とした新しい細胞治療医薬品の開発および販売に関する独占ライセンス契約
脳梗塞以外の適応症についてはライセンスオプション契約2018年6月に同社との提携を拡大し、日本における急性呼吸窮迫症候群に対する開発・販売ライセンスを取得した。
現在の状況
開発コード 対象 地域 開発段階 炎症 HLCM051 脳梗塞急性期 日本 Phase 2/3 先駆け審査指定 ARDS 日本 Phase 2 希少疾病用再生医療等製品指定 申請準備中
脳梗塞の治療:
脳梗塞は脳の血管が詰まり、その先の細胞に栄養が届かなくなり、脳の働きに障害が起きる。脳組織の壊死によって発症早期に大きな炎症がひき起こされ、炎症はそれから数日間続き、脳梗塞の病態が悪化する。
一般的に脳の血管に詰まった血の塊を溶かす「血栓溶解療法(t-PA治療)」や、閉塞した脳動脈内の血栓を直接回収する等で血流を再開させる「機械的血栓回収療法」が用いられるが、「血栓溶解療法」の適応は発症後4.5時間以内、「機械的血栓回収療法」でも8時間以内に限定される。
このため脳梗塞発症後から時間が経過した後でも、治療に効果的である新薬の開発が待ち望まれている。
HLCM051は、免疫応答の場である脾臓で炎症免疫細胞の活性化を抑制することにより、炎症や免疫反応を抑えて神経細胞の損傷を抑制、さらに、抗炎症性細胞を増殖させ、栄養因子を放出することで神経保護作用などが期待される。
同社は8月6日、ARDS患者への治験の結果を速報した。
投与後28 日間のうち人工呼吸器を装着しなかった日数は、標準治療群は11日に対し、HLCM051 投与群 は20日
投与後90日の死亡率は、標準治療群は42.9%に対し、HLCM051 投与群 は26.3%
安全性に問題は認められず。
引き続き本治験のデータの解析を続けるとともに、規制当局との相談を続けながら、製造販売承認申請に向けた準備を進める。
2021年8月、ヘリオスはAthersys, Inc. との契約を変更し、商用化に向けた新たなライセンス権等を取得するとともに、今後Athersysへのさらなる戦略的投資を可能にする新株予約権を引き受ける契約を締結した。
日本国内における、脳梗塞急性期およびARDS を対象とした治療薬の製造ライセンスを取得
日本国内向け治療薬の商用製造に関わる試験費用および製造キャパシティの拡張等に際し、その費用の一部を負担
(将来の支払いマイルストン金等から減額)脳梗塞急性期および ARDS 以外の新たな適応疾患(最大2疾患)を対象とした治療薬の開発・製造・販売に関するライセンスを取得するオプション権を取得
Athersysの普通株式を最大10 百万株新たに購入する権利を取得
2018年3月に提携関係の強化のため、同社株式 1,200 万株(21百万ドル)を取得、8.7%の筆頭株主
2020年3月に400万株(7百万ドル)を追加取得、これで9.4%の出資となる。
コメントする