Pfizerは11月5日、開発中の新型コロナウイルス向け飲み薬 PAXLOVID™の投与により入院や死亡するリスクを89%割減らせたとの臨床試験(治験)データを公表した。
緊急使用許可を得るため米食品医薬品局(FDA)に詳細なデータを提出する。
付記 Pfizerは11月16日、FDAに緊急使用許可(EUA)の承認を申請した。
付記
Pfizerは12月14日、PAXLOVIDによって、重症化しやすい患者の入院や死亡のリスクが89%減ったとする臨床試験の最終結果を公表した。
新たな変異株「オミクロン株」にも有効な可能性があるという。岸田首相は12月17日、Pfizer のCEOとの電話会談で、同社の経口薬 200万回分の確保で基本合意したことを明らかにした。
付記
EUの薬事当局「欧州医薬品庁(EMA)」は12月16日、PAXLOVIDについて緊急使用を認めるとの見解を発表した。重症化の危険性が高い成人を対象に使用できる。
発症してから5日以内の患者に投与したことで入院や死亡の可能性を軽減する結果が確認できた。
妊娠中や妊娠の可能性がある人、腎臓、肝臓の機能が著しく低下している人には使用できない。
PAXLOVID™は、開発中の新薬候補 PF-07321332と低用量のリトナビル(ritonavir)の合剤である。
発症後3日以内の患者に投与したところ、投与していないグループに比べて入院・死亡リスクが89%減った。デルタ型など各種の変異ウイルスに対しても効果がある可能性があるという。
報道によると、1回の治療につき30錠の錠剤を5日間かけて投与する。
米政府はPfizerとの間でPAXLOVID 170万回分の新薬調達を交渉しており、さらに330万回分の追加調達枠も確保する見通し。米政府側は1回の治療分につき約700ドルの支払いを見込む。
Pfizerは途上国に対しては、国連が支援する非営利団体を通じて割引価格で供給する模様。
ーーー
Pfizer は2021年3月、PF-07321332を健康な成人を対象とした第1相試験で、治験薬の安全性、忍容性、および薬物動態を評価した。
7月には、フェーズ2/3試験に進み、リトナビルと組み合わせて、診断が確定した参加者の有効性と安全性を評価した。
Pfizerは9月27日、COVID-19治療薬を予防薬としても使うPhase2/3の開始を発表した。感染した人と同居する人を対象とする。
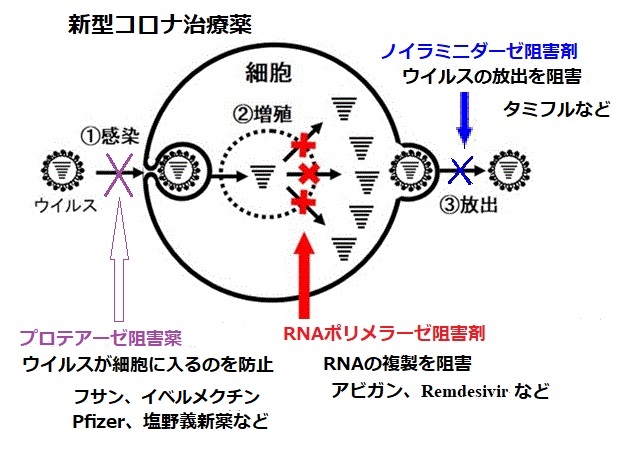
PF-07321332はプロテアーゼ阻害薬で、特に経口投与するように設計されているため、患者を入院させることなく、感染の最初の兆候または曝露の最初の認識時に処方できる可能性がある。
低用量のリトナビル(これも経口投与)との同時投与は、PF-07321332の代謝または分解を遅らせ、ウイルスとの闘いを助けるために高濃度で長期間、体内で活性を維持するのに役立つと期待している。
Ritonavir もプロテアーゼ阻害薬で、同じくプロテアーゼ阻害薬のLopinavirとの合剤(AbbVie Inc.が販売する商品名Kaletra)がHIV感染症のHAART療法に用いられている。
コメントする