中国国家薬品監督管理局は12月8日、騰盛博薬生物科技(Brii Biosicences)傘下の騰盛華創医薬技術の新型コロナウイルス感染症に対する中和抗体薬治療(抗体カクテル療法)を承認したと発表した。
中国当局が新型コロナ治療薬を承認するのは初めて。
騰盛博薬は英製薬大手GlaxoSmithKlineの元幹部、洪志・最高経営責任者(CEO)らが2017年に設立したバイオ企業で、中国と米国に本拠を置く。B型肝炎、COVID-19などの重大な感染症の治療法の進歩に取り組んでいる。2021年7月に香港取引所に上場した。
2020年3月31日にCOVID-19の治療薬開発のため、清華大学及び深圳市第三人民病院が開発したモノクローナル抗体の共同開発契約を締結した。
この薬は共同開発したamubarvimabモノクローナル抗体注射液「BRII-196」及びromlusevimabモノクローナル抗体注射液「BRII-198」によるカクテル療法で、騰盛博薬によると、 新型コロナウイルスのオミクロン株、デルタ株、デルタプラス株に対する中和活性を維持することが検証されたという。
発表文 https://www.briibio.com/news-detial.php?id=512#news
、
米国や南アフリカ、メキシコ、ブラジル、アルゼンチン、フィリピンの6か国で行った最終段階の臨床試験で、重症化する危険性の高い患者が入院したり死亡したりするリスクが80%減少したと説明した。臨床試験では、重症化リスクのある患者847人を薬を投与するグループと、プラセボ(偽薬)を投与するグループに分けて経過を比較。投薬後28日以内に死亡した人はゼロだった。
臨床試験を行った国を重点に世界中で申請を進めるとしている。 米国でこの療法の緊急使用許可を申請しているという。
騰盛博薬の関係責任者は、「中国国内の価格はまだ未定だが、生産能力には弾力性があり、ニーズを踏まえて調整されるだろう」と述べた。
騰盛博薬生物科技(Brii Biosicences)のパイプラインは 下図の通りで、米FDAに申請しようとしているものが多い。
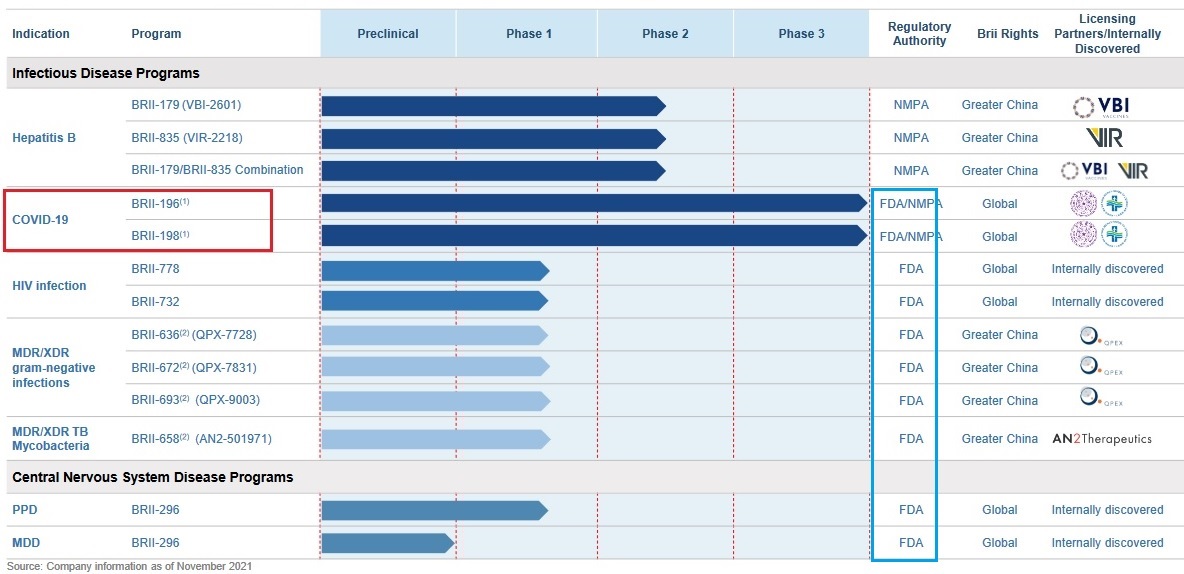
https://www.briibio.com/upload/BriiBio-Corporate-Presentation.pdf
コメントする