大阪大学の妻木範行教授らの研究グループは4月18日、ヒトのiPS細胞から椎間板の中心組織(軟骨様髄核組織)を作って、同じ組織を切り取ったネズミに移植したところ再生し、椎間板の変性を防ぐことができたと発表した。
椎間板は背骨のすき間でクッションの役割を果たしているが、加齢などにより変形したり、無くなったりすると腰痛を引き起こす原因になる。
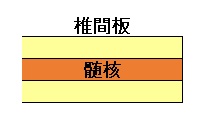
椎間板の中心部分を構成する組織が髄核で、脊椎にクッション性と可動性を与える。髄核の変性・消失は腰痛の原因になり、変性した髄核は治らない。再生治療が期待されているが、移植して髄核の代わりをする、即ち置換するような組織はなかった。
|
今回、研究グループは、髄核と軟骨の遺伝子発現を単一細胞レベルで網羅的に調べることにより、髄核の中の軟骨様髄核組織の性質を明らかにした。
椎間板は、中心部の髄核とそれを取り囲む線維輪で構成される。髄核は髄核細胞と髄核細胞が作る細胞外マトリックスからなる。
髄核の細胞外マトリックスの粘弾性・流体特性が、脊椎にクッション性と多方向への可動性をもたらす。また、細胞外マトリックスは、髄核細胞に適切な環境を提供することにより髄核細胞の分化に貢献している。
そして、ヒトiPS細胞を分化誘導することによって、遺伝子発現プロファイルが軟骨様髄核組織に似た組織(hiPS-Cart)を用意し、脊椎の髄核を摘出した動物モデルに移植した。
移植したヒトhiPS-Cartは少なくとも6ヶ月の長期にわたって生着し、椎間板の変性を防ぐことが明らかになった。力学試験により、移植組織は正常椎間板に近い力学特性を持つことが分かった。
さらに、移植後も椎間板の低酸素環境に順応した細胞分化をすることが分かった。髄核を置換する役割を果たしたことを示唆している。
日本では、約1300万人が腰痛を患い、その20-40%は椎間板変性が原因となっている。椎間板変性は、多くの場合において髄核の変性・消失から始まると考えられている。
研究グループは有効性や安全性を確認する実験を経て、3年後をめどに臨床研究を行いたいとしている。
2022年3月30日に国際科学誌「Biomaterials」に掲載された。
"Human iPS cell-derived cartilaginous tissue spatially and functionally replaces nucleus pulposus"
ーーーーーー
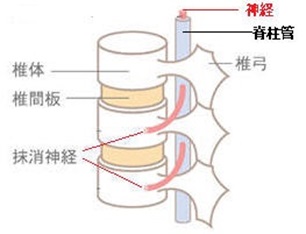
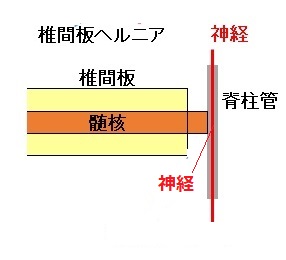
逆に、椎間板の中心部分にある髄核や外側の線維輪の一部が突出することで脊椎周辺の神経を圧迫し、痛みやしびれを引き起こす疾患が腰椎椎間板ヘルニアである。
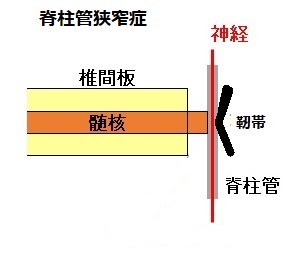
椎間板ヘルニアや黄色靱帯(脊柱管の後方にある椎弓の間を結ぶ靱帯)が厚くなることで脊柱管を圧迫して狭くし(狭窄)、それによって脊柱管のなかの神経が圧迫を受けるのが脊柱管狭窄症である。
腰椎椎間板ヘルニアの治療には、手術をする方法と、保存療法(鎮痛剤薬、神経ブロック注射、温熱療法、牽引療法等)があったが、根本治療となる薬物療法は存在しなかった。
生化学工業は2013年1月、腰椎椎間板ヘルニアを適応症とするSI-6603(一般名:コンドリアーゼ)について厚生労働省に製造販売承認申請を行ったと発表した。
2018年3月23日に承認、5月22日に薬価収載され、8月1日に科研製薬より発売された。
コンドリアーゼは、髄核の構成成分であるグリコサミノグリカン(GAG:コンドロイチン硫酸やヒアルロン酸等)を特異的に分解するコンドリアーゼという酵素を利用した注射薬で、椎間板内に直接投与することにより、GAGを分解して髄核を縮小させることで、神経への圧迫を減少させる。
タンパク質を分解しないため、血管や神経などの周辺組織に影響を与えないとされる。
2014/6/11 生化学工業、椎間板ヘルニア治療薬を開発
コメントする