付記
厚生労働省の専門家分科会は11月22日、「ゾコーバ」の緊急承認を了承した。安全性を確認したほか、症状改善を早める有効性が推定できると判断した。 厚労省は同日、承認した。
軽症者に使える初の国産飲み薬となる。
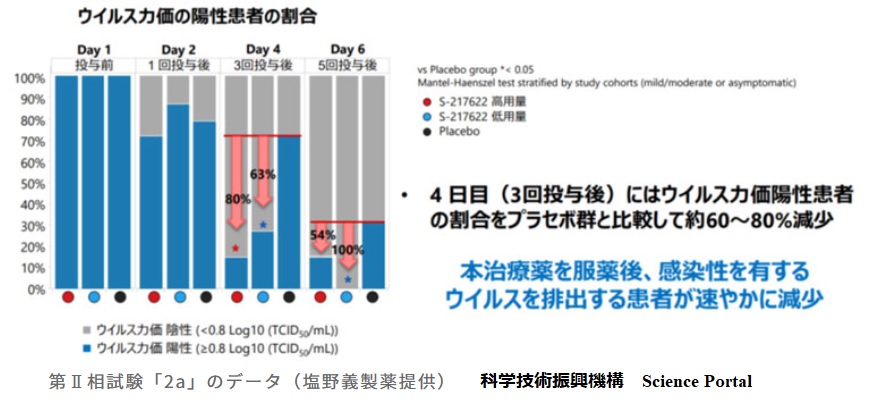
塩野義は9月、最終段階の臨床試験(治験)のデータを公表した。軽症・中等症の患者が1日1回、5日間服用し、鼻水や発熱、せきなど5症状が消えるまでの時間が約8日から約7日に短縮することを示した。ウイルス量減少も報告した。
5症状〔①倦怠感又は疲労感、②熱っぽさ又は発熱、③鼻水又は鼻づまり、④喉の痛み、⑤咳〕の全てが消える時間であり、 下図の通りウイルス量は早くに減少するため、多くの症状は早く消える。患者への効果は大きい。
投与により患者のウイルス量は4日目には大きく減少しており、感染防止上の効果は大きい。
厚労省は塩野義との間で100万人分の供給契約を結んでいる。
緊急承認の場合、通常の承認を取り直す必要がある。1年ほどの期限内に効果を確認できなければ、承認は取り消される。
ーーー
塩野義製薬は2022年2月25日、開発中の経口抗ウイルス薬(開発番号:S-217622)について、第2/3相臨床試験のうちPhase 2b partの主要評価項目に関する解析が完了し、日本国内における条件付き早期承認制度の適用を希望する製造販売承認申請を行ったと発表した。 商品名 「ゾコーバ錠 (Xocova)」(エンシトレルビル)
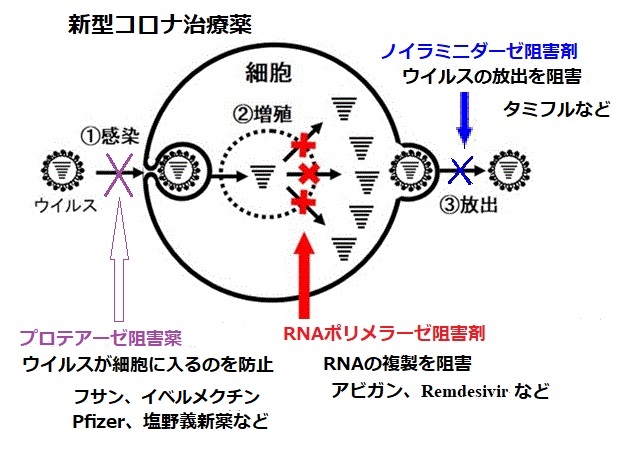
3CLプロテアーゼ阻害薬で、SARS-CoV-2の3CLプロテアーゼを選択的に阻害することで、SARS-CoV-2の増殖を抑制する。
2022/2/12 塩野義製薬、新型コロナ飲み薬 承認申請へ
後藤厚労相は3月25日、塩野義が開発した新型コロナウイルスの飲み薬の購入について基本合意したと明らかにした。
薬事承認されればまず100万人分を確保し、その後も一定数量を調達する。
塩野義は、5月施行の改正医薬品医療機器法(薬機法)で緊急承認制度が導入されたことを受け、5月末に緊急承認制度の適用を求める申請を行った。
「国民の生命及び健康に重大な影響を与えるおそれがある疾病のまん延その他の健康被害の拡大を防止するため緊急に使用されることが必要な医薬品であり、
かつ、当該医薬品の使用以外に適当な方法がないこと」承認は2年程度の期限付きとなる。
https://www.mhlw.go.jp/hourei/doc/tsuchi/T220523I0010.pdf
6月22日、薬事・食品衛生審議会医薬品第二部会を開催、製造販売承認の可否などを審議したが、「本日の議論を踏まえ、さらに慎重に議論を重ねる必要がある」として、次回、薬食審の分科会と医薬品第二部会の合同会議を開催し、そこで緊急承認の可否を審議することにした。
専門家分科会は7月20日、「ゾコーバ」の承認を見送り、継続審議にすると決めた。緊急承認に向けて有効性などのデータが十分ではないと判断した。
ーーー
厚労省は「承認了承」を見越して、この決定の前の7月19日に、「ゾコーバ」について100万人分の購入契約を締結していた。
後藤厚労相は22日の閣議後会見で、今後の承認を前提に塩野義との間で契約を締結したとし、ゾコーバが「実用化されれば、治療の選択肢がさらに広がるものと考えている」と述べた。実際の購入は承認後になる予定。
厚労省は合同会議に提出した「考え方」で、今後の選択肢の一つに「現下の急速な感染拡大」を踏まえ、ウイルス量や一部の臨床試験の結果で有効性が推定できれば「承認を可とすることもできる」との文言を入れた。
しかし、オミクロン株流行下で行った中間段階の治験では、体内のウイルス量の減少効果は確認したが、12種類の症状改善の総合評価では効果が明らかではなかった。 承認の要件の一つ「有効性の推定」をほぼ否定する厳しい内容だった。
ゾコーバの安全性について、「大きな懸念は認められない」としつつ、米ファイザー社のパキロビッドと同様に他の薬との「併用禁忌」が多く、胎児に異常を及ぼす「催奇形性」への懸念から妊婦の使用を禁じるとしたことも審議に影響した。
緊急承認は、感染症などによる健康被害の拡大を防ぐために急きょ必要な薬や医療機器が対象で、代替手段がないことが要件となる が、2種類の飲み薬が特例承認されている。
2021年12月24日に米Merckの抗ウイルス薬「モルヌピラビル」(「ラゲブリオ」)が特例承認された。
2022年2月10日にPfizerの抗ウイルス薬「ニルマトレルビル・リトナビル」(「パキロビッド」)が特例承認された。
最終的に、塩野義が2022年11月以降にも結果をまとめる最終段階の臨床試験(治験)データを待つという結論になった。
コメントする