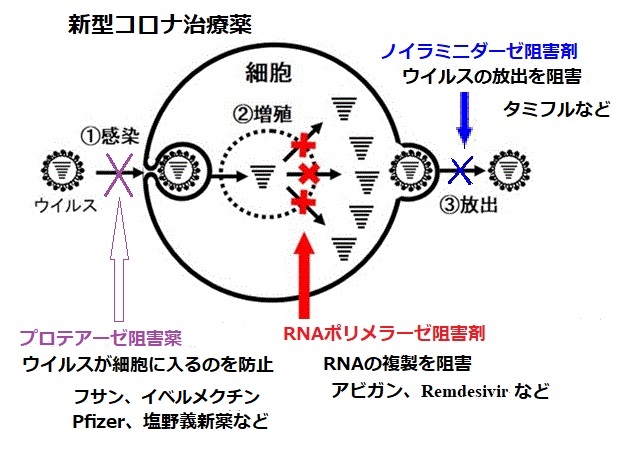
新型コロナウイルス(SARS-CoV-2)は3CLプロテアーゼというウイルスの増殖に必須の酵素を有している。本治療薬は、北海道大学と塩野義製薬の共同研究から創製された3CLプロテアーゼ阻害薬で、SARS-CoV-2の3CLプロテアーゼを選択的に阻害することで、SARS-CoV-2の増殖を抑制する。
同社は国内第2/3相臨床試験を2021年9月27日に開始した。
2021/7/28 塩野義製薬、COVID-19治療薬の臨床試験開始
塩野義製薬は2022年2月25日、第2/3相臨床試験のうちPhase 2b partの主要評価項目に関する解析が完了し、日本国内における条件付き早期承認制度の適用を希望する製造販売承認申請を行ったと発表した。 商品名 「ゾコーバ錠」
後藤厚労相は3月25日、塩野義が開発した新型コロナウイルスの飲み薬の購入について基本合意したと明らかにした。
薬事承認されればまず100万人分を確保し、その後も一定数量を調達する。
塩野義は、5月施行の改正医薬品医療機器法(薬機法)で緊急承認制度が導入されたことを受け、5月末に緊急承認制度の適用を求める申請を行った。
専門家分科会は7月20日、「ゾコーバ」の承認を見送り、継続審議にすると決めた。緊急承認に向けて有効性などのデータが十分ではないと判断した。
2022/7/25 塩野義コロナ飲み薬、「緊急承認」見送り
ーーー
日本、韓国、ベトナムにおいて重症化リスク因子の有無、またワクチン接種の有無にかかわらず、1,821例の患者が登録された。
主要評価項目は、発症から72時間未満に割付された患者集団における、オミクロン株流行期に国内で共通してみられる特徴的な5症状(鼻水または鼻づまり、喉の痛み、咳の呼吸器症状、熱っぽさまたは発熱、けん怠感 (疲労感))の消失までの時間で、医学専門家や日米の規制当局との協議を経て、その科学的かつ医学的妥当性を踏まえた上で設定した 。
同社ではこの速報結果については、厚生労働省および医薬品医療機器総合機構へ共有済みであり、今後の承認審査ならびに審議について、両組織との協議を開始しており、本試験に関連する全データの早期提出に向けて、データ解析および申請文書の作成に鋭意取り組んでいく。
コメントする