エーザイは9月28日、アルツハイマー病の新薬の抗アミロイドβ(Aβ)プロトフィブリル抗体LECANEMAB(BAN2401)について、
アルツハイマー病による軽度認知障害および軽度アルツハイマー病(総称して早期アルツハイマー病)を対象とした大規模なグローバル臨床第Ⅲ相Clarity AD検証試験において、
主要評価項目ならびに全ての重要な副次評価項目を統計学的に高度に有意な結果をもって達成し、良好なトップライン結果を取得した、と発表した。
「主要評価項目」は、認知症の幅広いステージの重症度を評価するスケールであり、記憶、見当識、判断力と問題解決、地域社会の活動、家庭および趣味、身の回りの世話の6項目について、当事者の診察や家族および介護者からの情報で評価する。
早期アルツハイマー病患者1,795人を対象とした、プラセボ対照、二重盲検、並行群間比較、無作為化グローバル臨床第Ⅲ相検証試験。包括的な被験者登録基準と民族・人種多様性の確保の結果、米国においてはメディケア加入者と概ね同様な分布となった。
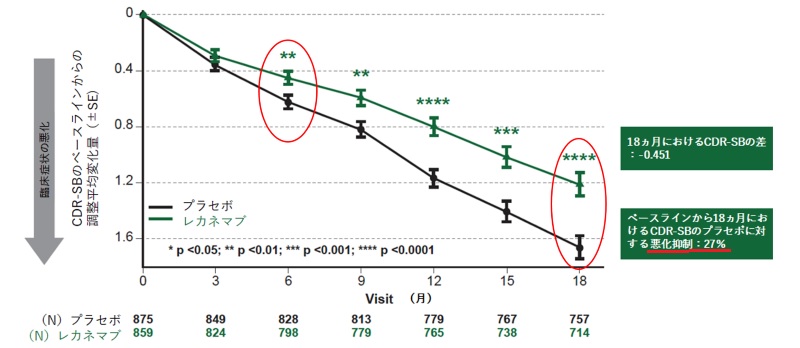
治験は2019年3月からアメリカや日本、それにヨーロッパなどで軽度の認知症の患者や発症の前段階の患者を対象に行われ、2週間に1回のペースで薬を投与するグループと偽の薬を投与するグループに分けて、医師などが評価する形で患者の認知機能の変化などを調べた。
その結果、投与から1年半たった時点で、「レカネマブ」を投与したグループでは、症状の悪化が27%抑えられ、有効性が確認できたとしている。
付記
エーザイとBiogen, Inc.は11月30日、LECANEMAB(BAN2401)について、大規模なグローバル臨床第Ⅲ相Clarity AD検証試験の結果を第15回アルツハイマー病臨床試験会議において発表した。
プラセボとの比較で認知機能の低下を27%抑制したことを報告した。
--------
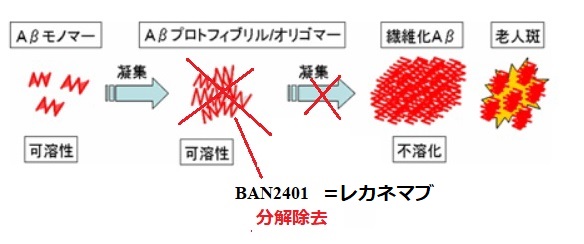
アルツハイマー型認知症は脳内にベータ・アミロイド(Aβ)が凝集し、中間体(Aβプロトフィブリル)が神経変性過程を誘発・促進すると示唆されている。
アルツハイマー病免疫療法には、Aβを投与して生体内でAβに対する免疫反応を惹起させるワクチン療法や、Aβをターゲットとしたモノクローナル抗体を投与する抗体療法がある。
LECANEMAB(BAN2401)は、アルツハイマー病に対する免疫療法剤創製を目的としたヒト化モノクローナル抗体で、ベータ・アミロイド(Aβ)を分解除去する。
Prof. Lannfeltの家族性アルツハイマー病の原因であるアークティック変異Aβに関連する研究に基づいたもので、同博士が設立したスウェーデンのBioArctic Neuroscience ABが開発した。
2022年度中の米国におけるフル承認申請、ならびに日本、欧州における販売承認申請をめざし、各国当局と協議を行う。
米国において、レカネマブは、2022年7月に迅速承認制度に基づく生物製剤ライセンス申請がFDAに受理され、現在審査中。
日本においても、2022年3月より、医薬品事前評価相談制度を活用し、本検証試験以外の申請データを医薬品医療機器総合機構に提出している。これにより、今回の試験に基づく申請に対する審査期間を短縮し、一日でも早くレカネマブを患者に届けることをめざす。
レカネマブについて、エーザイは、開発および薬事申請をグローバルに主導し、エーザイの最終意思決定権のもとで、エーザイとバイオジェンが共同商業化・共同販促を行う。
ーーー
エーザイとBiogenは2014年3月に提携を開始した。
現状は次の通りで、アリセプトを除き、開発で提携している。
| エーザイ | アリセプト 〈提携対象外〉 (donepezil) |
エーザイの杉本八郎博士らが開発 |
アルツハイマーでは、神経伝達物質のアセチルコリンが脳内で減少している。
アセチルコリンを分解するアセチルコリンエステラーゼの作用を阻害することで、アセチルコリンの濃度を高める。 |
| 新規ヒト化モノクローナル抗体 「BAN2401」LECANEMAB 今回効果確認 |
2007/12 スウェーデンのBioArctic Neuroscience ABから全世界の研究・開発、製造、販売の独占ライセンスを受ける。 | アルツハイマー病の原因と考えられるベータ・アミロイド成分を除去 | |
| βサイト切断酵素(BACE)阻害剤 elenbecestat「E2609」 x試験中止 |
エーザイが創製
|
アミロイド前駆体タンパク質のβサイト切断酵素であるBACEを阻害することでβアミロイドの総量を低下させる。 | |
| Biogen | 抗アミロイドβ(Aβ)抗体 aducanumab(ADUHELM) 2021/6/7 迅速承認→ 監査部門に調査を要請 2021/12/22 厚労省 継続審議 |
Neurimmune社より共同開発およびライセンス契約締結のもとに導入 | アミロイド斑(プラーク)は、アミロイドβ蛋白が蓄積したもので、アルツハイマー病患者の脳にみられる。
aducanumab 投与でアミロイドプラークのレベルを下げる |
これまで、aducanumab(ADUHELM)が先行していた。しかし、問題が生じた。
米食品医薬品局(FDA)は2021年6月7日、エーザイと米バイオジェンが共同で開発するアルツハイマー型認知症治療薬候補ADUHELM(一般名:アデュカヌマブ)について、脳内のアミロイドβプラークを減少させることにより、アルツハイマー病の病理に作用する初めてかつ唯一の治療薬として、迅速承認(accelerated approval)したと発表した。
従来の認知症薬とは異なり、認知機能の低下を長期的に抑制する機能を持つとして世界で初めて承認された。
2021/6/8 エーザイとバイオジェンのアルツハイマー新薬、米で承認
米食品医薬品局(FDA)のJanet Woodcock長官代行は2021年7月9日、ADUHELM(一般名:アデュカヌマブ)について、FDAの承認手続きに疑義が生じたとして、米保健福祉省の監査部門に調査を要請したと発表した。
2021/7/12 FDA、アルツハイマー新薬承認手続きにつき調査を要請
欧州医薬品庁(EMA)の医薬品委員会は2021年12月17日、「アデュカヌマブ」について、薬の効果と臨床的改善との関連性が「確立されていない」として販売を承認しない勧告を発表した。
Biogenは2022年4月22日、販売承認申請を取り下げた。
厚生労働省の専門部会は2021年12月22日、米製薬会社 Biogenと日本のエーザイが共同開発したアルツハイマー病の新薬 「アデュカヌマブ」の国内での製造販売承認について、今後の臨床試験(治験)結果などを待って再び審議する「継続審議」とした。専門部会は「現時点のデータからは有効性を明確に判断するのが困難」と指摘した。2021/12/24 エーザイのアルツハイマー新薬、再審議
エーザイはアデュカヌマブのほか、Biogenと共同開発しているアルツハイマー治療薬BAN2401について2022年度中に承認申請を目指してきた。
2020/9/24 エーザイ、認知症薬を2022年度に承認申請へ
コメントする