エーザイとBiogenは1月7日、米国FDAがアルツハイマー病の新薬の抗アミロイドβ(Aβ)プロトフィブリル抗体LECANEMAB(開発コード:BAN2401、米国ブランド名:LEQEMBI™ 注射 100 mg/mL 溶液)について、アルツハイマー病の治療薬として、迅速承認した と発表した。
本承認は、LEQEMBI が アルツハイマー病 の特徴である脳内に蓄積した Aβ プラークの減少効果を示した臨床第II相試験(201 試験)の結果に基づくもの 。
付記
エーザイは1月11日、「レカネマブ」について、欧州医薬品庁(EMA)に販売承認を申請したと発表した。2023年度中の承認を目指す。日本でも22年度中に承認を申請する。
付記
エーザイは1月16日、厚生労働省所管の医薬品医療機器総合機構(PMDA)に承認を申請したと発表した。
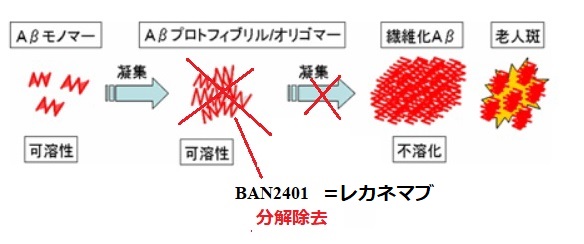
アルツハイマー型認知症は脳内にベータ・アミロイド(Aβ)が凝集し、中間体(Aβプロトフィブリル)が神経変性過程を誘発・促進すると示唆されている。
アルツハイマー病免疫療法には、Aβを投与して生体内でAβに対する免疫反応を惹起させるワクチン療法や、Aβをターゲットとしたモノクローナル抗体を投与する抗体療法がある。
LECANEMAB(BAN2401)は、アルツハイマー病に対する免疫療法剤創製を目的としたヒト化モノクローナル抗体で、ベータ・アミロイド(Aβ)を分解除去する。
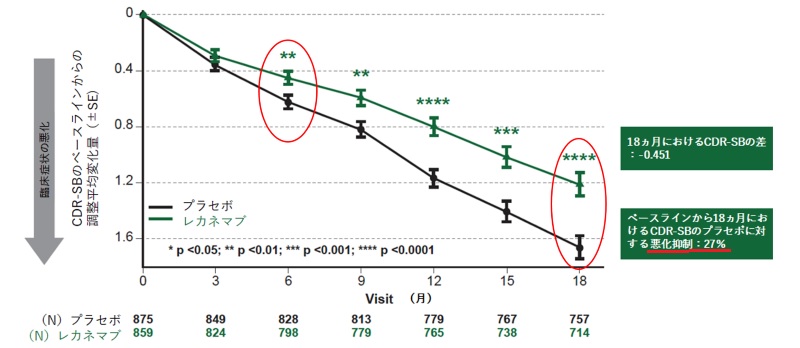
エーザイとBiogen, Inc.は2022年11月30日、LECANEMAB(BAN2401)について、大規模なグローバル臨床第Ⅲ相Clarity AD検証試験の結果を第15回アルツハイマー病臨床試験会議において発表した。
プラセボとの比較で認知機能の低下を27%抑制したことを報告した。
2022/9/29 エーザイ、アルツハイマー病の新薬で "症状悪化抑える効果確認"
FDAは1992年から迅速承認(accelerated approval)プログラムを開始した。
重篤もしくは生命を脅かすような疾患を対象として、臨床上の有用性が予測できるようなサロゲート(代替)エンドポイントに基づいて医薬品を評価、承認するというもので、市販後に、臨床上の有用性を示すことのできる評価項目を用いて検証試験を実施するということが条件となっている。市販後の検証試験結果によっては、承認が取り消される。
本適応症は、LEQEMBI の治療により観察された Aβ プラークの減少に基づき、迅速承認の下で承認されており、検証試験により臨床的有用性を確認することが要件となっている。
エーザイは、最近発表した大規模なグローバル臨床第III相検証試験である Clarity AD 試験のデータを用い、フル承認に向けた生物製剤承認一部変更申請を FDA に対して1月7日に行った。
内藤社長は「日本で一日も早く申請する」と述べた。「新薬の対象患者は2030年に約250万人にのぼる」と予想する。欧州や中国でも早期の実用化を目指しており、「2年目後半から3年目にかけての利益貢献を」目指している。
今回承認された LEQEMBI の適応症は、アルツハイマー病の治療で、軽度認知障害または軽度認知症の患者において開始する必要がある。
上図の通り、LEQEMBIは脳内にベータ・アミロイド(Aβ)が凝集するのを防止する。
既に凝集し、中間体(Aβプロトフィブリル)が神経変性過程を誘発・促進した後では効果がない。
軽度認知障害または軽度認知症よりも早期または後期段階での治療開始に関する安全性と有効性のデータはない。症状が悪化すると使えない。
このため、患者に薬が使えるかどうかを確認するため、脳内のアミロライドベータの蓄積量を事前にPETや脳脊髄液(CSF)といった検査で調べる必要がある。
PET検査には数十万円かかる。CSFは麻酔をかけるため身体への負担が大きい。
普及にはしっかり診断できる専門医や施設が必要とされる。
LEQEMBI の米国での発売価格を年間 26,500ドルに設定した。10㎎/kg を推奨用量として 2週間に 1 回点滴静注する。
正式に承認され、高齢者向け公的医療保険 Medicare の適用対象になれば、自己負担額は1日あたり14.5ドルになると推定している。
今後、日本で承認された場合は、公的保険診療になることが見込まれる。通常は米国よりも薬価が抑えられるが、それでも百万円単位になるとみられる。
患者の自己負担は、国の高額療養費制度があるため、70歳以上の一般所得層(年収156万~約370万円)の場合は年14万4000円が上限になる。
ーーー
エーザイとBiogenは2014年3月に提携を開始した。
現状は次の通りで、アリセプトを除き、開発で提携している。
| エーザイ | アリセプト 〈提携対象外〉 (donepezil) |
エーザイの杉本八郎博士らが開発 |
アルツハイマーでは、神経伝達物質のアセチルコリンが脳内で減少している。
アセチルコリンを分解するアセチルコリンエステラーゼの作用を阻害することで、アセチルコリンの濃度を高める。 |
| 新規ヒト化モノクローナル抗体 「BAN2401」LECANEMAB 今回FDAが迅速承認 |
2007/12 スウェーデンのBioArctic Neuroscience ABから全世界の研究・開発、製造、販売の独占ライセンスを受ける。 | アルツハイマー病の原因と考えられるベータ・アミロイド成分を除去 | |
| βサイト切断酵素(BACE)阻害剤 elenbecestat「E2609」 x試験中止 |
エーザイが創製
|
アミロイド前駆体タンパク質のβサイト切断酵素であるBACEを阻害することでβアミロイドの総量を低下させる。 | |
| Biogen | 抗アミロイドβ(Aβ)抗体 aducanumab(ADUHELM) x→ 申請→FDA優先審査 2021/6/7 迅速承認→監査部門に調査を要請 2021/12/22 厚労省 継続審議 |
Neurimmune社より共同開発およびライセンス契約締結のもとに導入 | アミロイド斑(プラーク)は、アミロイドβ蛋白が蓄積したもので、アルツハイマー病患者の脳にみられる。
aducanumab 投与でアミロイドプラークのレベルを下げる |
米食品医薬品局(FDA)は2021年6月7日、エーザイと Biogenが共同で開発するアルツハイマー型認知症治療薬候補ADUHELM(一般名:アデュカヌマブ)について、脳内のアミロイドβプラークを減少させることにより、アルツハイマー病の病理に作用する初めてかつ唯一の治療薬として、迅速承認(accelerated approval)したと発表した。
従来の認知症薬とは異なり、認知機能の低下を長期的に抑制する機能を持つとして世界で初めて承認された。
2021/6/8 エーザイとバイオジェンのアルツハイマー新薬、米で承認
米厚生省のCenters for Medicare & Medicaid Services(CMS)は2022年4月7日、米Biogenがエーザイと共同開発したアルツハイマー病治療薬ADUHELM(一般名:アデュカヌマブ)のMedicare(高齢者・障害者向け医療保険制度)適用対象について、特定の臨床試験に参加する患者に制限する計画を最終決定した。
これにより、アルツハイマー病患者の大半はADUHELMへのアクセスを事実上阻まれる。これの撤回を働き掛けていたBiogenにとり、今回の最終決定は打撃となった。
ただ、CMSの当局者は、将来の大規模試験で臨床的利点が明確に示され、米食品医薬品局(FDA)から完全な承認を得たアルツハイマー病治療薬については、Medicareの適用対象をより幅広くするとしている。
2022/4/11 バイオジェンのアルツハイマー薬、米 Medicareが給付対象を大幅制限
コメントする