米医薬品大手Ely Lillyは5月3日、同社が開発したアルツハイマー病治療薬「ドナネマブ (Donanemab) 」の後期臨床試験で、ドナネマブを投与した患者は薬効のない偽の薬(プラセボ)を投与した患者に比べて認知機能の低下が35%抑えられたとの結果を発表した。
ドナネマブは臨床試験での全ての目標を達成した。
アルツハイマー病の初期段階と診断された1182人を対象にした臨床試験で、投与を受けた人の認知機能の低下は、プラセボを投与された人と比べて35―36%遅らせることができた。効果がみられた対象患者は脳のスキャン画像でアミロイドたんぱくの脳内沈着とタウたんぱくが中間水準であることを示していた。
他にタウたんぱくが高水準だった552人の患者に実施した試験では、あまり効果がない可能性が高いことが示唆された。
これらの両方の患者を合わせたドナネマブの試験結果で、認知機能と日常生活を送るための活動を測定するためにIly Lillyが開発した基準で22%、より一般的な認知症進行の基準では29%、それぞれアルツハイマー病の進行を遅らせることが可能なことを示した。
対象者の約24%で脳の腫れ、これと重複する31.4%で脳の出血がみられ、同様の薬にみられる副作用があった。
アルツハイマー病協会の最高科学責任者は「今回のデータは、これまでのアルツハイマー病治療薬の第3相試験の結果としては最も強力だ」と評価している。
Ely Lillyは2021年6月末に、アルツハイマー病薬「Donanemab」が画期的治療薬の指定を受けたと発表した。
画期的医薬品指定制度は2012年のFDA安全・イノベーション法により規定された。同制度は、既存治療法を上回る劇的な改善を示す製品の開発の迅速化を目指すもので、具体的には、FDAは開発が順調に進むように上級幹部を早くから関与させ、指定製品の臨床試験を簡略化することを認める。
同社は2023年1月19日、「Donanemab」についてFDAが迅速承認(Fast track)を認めなかったと発表した。
迅速承認は、重篤もしくは生命を脅かすような疾患を対象として、臨床上の有用性が予測できるような代替的な評価項目に基づいて医薬品を承認する仕組みで、いわば仮免許であり、その後の検証的試験で臨床的有用性を示すことなどが必要となる。
しかし、審査ではFDAへの臨床試験データ提出で、同薬で少なくとも12か月治療した患者のデータ数が不十分とされた。
2023/1/25 米イーライリリーのアルツハイマー薬、FDAが迅速承認を認めず
今回の治験で十分な人数分のデータが集まったとされる。
同社は米国では6月までに、日本でも年内に承認申請する。
ーーー
アルツハイマー型認知症の原因は未だ解明されていないが、進行に伴っていくつかの特有の病変が見られる。例えば、神経細胞の外側では「アミロイドβ」が蓄積して老人班を形成し、神経細胞の中では「タウタンパク」が蓄積してタンパク質が糸くず状に変化したようなもの(神経原繊維変化)が見られるようになる。
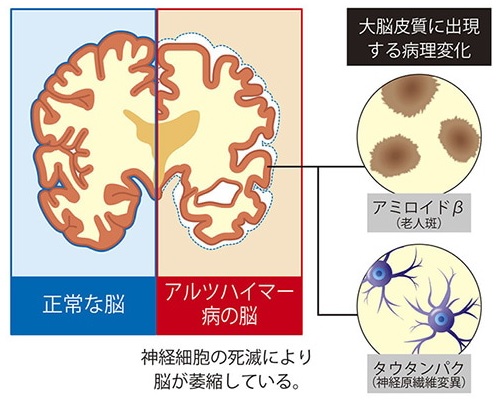
「Aβ(アミロイドβ)仮説」: 脳の神経細胞外にAβが蓄積→タウ蛋白のリン酸化→神経原線維変化→細胞毒性が生じ、神経細胞が死滅→認知症を発症
抗Aβ抗体:Aβを除去
抗タウ抗体:タウを除去したり、タウの凝集を阻害
T-817MA:神経細胞保護効果や神経突起伸展促進効果のあるT-817MA投与で、リン酸化タウの減少を確認。
Ely Lilly 「ドナネマブ」
Aβペプチドは脳内に沈着し、過剰になると互いに結合してタンパク質プラークを形成するが、ドナネマブはこのタンパク質プラークを標的とし、脳内で負担となる余分なタンパク質を除去する。
(単に新しいプラークの沈着または既存のプラークの成長を防ぐのではなく、沈着したプラーク自体を標的にすることが、脳から既存のアミロイド負荷を取り除くために必要)以前のプラーク結合抗体のいくつかは、脳に微小出血を引き起こしたために放棄されたが、これは微小出血を引き起こすことなくマウスのプラークを除去することが報告されている。
詳細は 2021/8/17 アルツハイマー病治療薬を巡る話題
ーーー
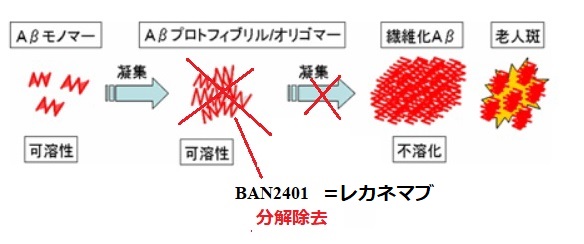
エーザイとBiogenは2013年1月7日、米国FDAがアルツハイマー病の新薬の抗アミロイドβ(Aβ)プロトフィブリル抗体LECANEMAB(開発コード:BAN2401、米国ブランド名:LEQEMBI™ 注射 100 mg/mL 溶液)について、アルツハイマー病の治療薬として、迅速承認したと発表した。
LECANEMAB(BAN2401)は、アルツハイマー病に対する免疫療法剤創製を目的としたヒト化モノクローナル抗体で、ベータ・アミロイド(Aβ)を分解除去する。
エーザイは1月11日、「レカネマブ」について、欧州医薬品庁(EMA)に販売承認を申請したと発表した。1月16日に、厚生労働省所管の医薬品医療機器総合機構(PMDA)に承認を申請したと発表した。
2023/1/9 エーザイのアルツハイマー治療薬、FDAから迅速承認を取得
コメントする