厚生労働省は5月26日に薬事・食品衛生審議会再生医療等製品・生物由来技術部会を開き、遺伝性網膜ジストロフィー(IRD)に対するノバルティスファーマの遺伝子治療「ルクスターナ」(Luxturna、一般名:voretigene neparvovec)の承認を了承した。 6月中にも正式承認される見通し。
眼科領域の遺伝子治療薬は初の承認で、「両アレル性RPE65 遺伝子変異による遺伝性網膜ジストロフィー」を効能・効果または性能とする。
RPE65という遺伝子には、網膜の視細胞が光を感じるのに必要な物質を作る際に働く酵素の情報が載っている。この酵素が遺伝的に欠損していたり、働きが悪かったりすると、視細胞が光を感じるのに必要な物質を作ることできず、視細胞の光感受性能が著しく低下する。 (RPE65 は,網膜視細胞の光受容に必要なビタミン A 代謝産物である 11- シスレチナールの合成に必要な酵素をコードするため、この酵素が遺伝的に欠損すると,眼内で 11 シスレチナールの生成ができなくなり,視細胞の光感度の大幅な低下が生じる。)
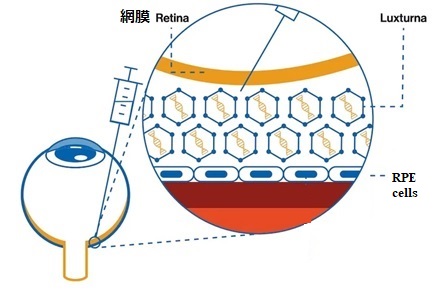
遺伝学的検査によりRPE65 遺伝子の両アレル性の変異が確認されたIRD患者が投与対象となる。
用法・用量または使用方法は「通常、1.5×1011 ベクターゲノム(vg)/ 0.3mLを各眼の網膜下に単回投与する。各眼への網膜下投与は、短い投与間隔で実施するが、6日以上あけること。同一眼への本品の再投与はしないこと」となっている。
海外では、2017年に米国で、2018年に欧州で承認されており、2022年8月時点で40 以上の国または地域で承認されている。
承認されれば、
アンジェスの「コラテジェン」(べぺルミノゲンペルプラスミド)、
ノバルティスファーマの「ゾルゲンスマ」、
第一三共の「デリタクト」(テセルパツレブ)
に次いで国内4番目のin vivo(生体内)遺伝子治療で、眼科領域の遺伝子治療としては国内初となる。In Vivo遺伝子治療は直接生体内に遺伝子を導入する方法。
他に、ex vivo(生体外)遺伝子治療としてノバルティスファーマの「キムリア」が承認されている。Ex vivo遺伝子治療は体の外で遺伝子導入する方法。
ーーー
キムリア点滴静注(一般的名称:チサゲンレクルユーセル、申請企業:ノバルティスファーマ)CAR-T細胞治療
キムリア(CAR-T細胞療法)は、患者の血液中の免疫細胞(T細胞)を取り出して外部で遺伝子導入することでT細胞を強力にし、さらにそれを培養して増やした後患者の体の中に注射して戻す治療法
「再発または難治性CD19陽性のB細胞性急性リンパ芽球性白血病(B-ALL)」と「再発または難治性びまん性大細胞型B細胞リンパ腫(DLBCL)」を効能・効果とする。
希少疾病用再生医療等製品。厚労省によると、推定される投与対象患者数はピーク時で年間250例程度。2019/2/22 厚労省部会、国内初の遺伝子治療2品目の承認を了承
コラテジェン筋注用4mg(一般的名称:ベペルミノゲン ペルプラスミド、申請企業:アンジェス)
「標準的な薬物治療の効果が不十分で血行再建術の施行が困難な慢性動脈閉塞症(閉塞性動脈硬化症及びバージャー病)における潰瘍の改善」
2019/2/22 厚労省部会、国内初の遺伝子治療2品目の承認を了承アンジェスは2023年5月31日、「コラテジェンⓇ筋注用4mg」について、厚生労働省に、慢性動脈閉塞症の下肢潰瘍の改善を効能、効果又は性能として、改めて製造販売の承認申請を行った。2019年3月に条件及び期限付製造販売承認を取得しているが、承認期限内に承認条件評価の結果を改めて承認申請することになっている。本件が承認された場合、再生医療等製品の条件及び期限付承認制度の導入後、初めて条件解除の承認を受ける製品となる。
ゾルゲンスマ(一般的名称:オナセムノゲンアベパルボベク、申請企業:ノバルティスファーマ)脊髄性筋萎縮症
脊髄性筋萎縮症は遺伝的要因により、脊髄等の運動神経細胞が変性・脱落することで、筋収縮刺激がうまく伝達できなくなる疾患。
ゾルゲンスマはウイルスを利用して静脈注射で患者に正常な遺伝子を導入する。
厚生労働省の専門部会は2020年2月26日、世界一高い薬とされる脊髄性筋萎縮症の遺伝子治療薬「ゾルゲンスマ」の国内での製造販売を了承した。2019/5/29 米 FDA、世界一高額の難病治療薬を承認
デリタクト:世界初の脳腫瘍ウイルス療法
東京大学医科学研究所附属病院 脳腫瘍外科の藤堂具紀教授らの研究グループは、単純ヘルペスウイルス1型(口唇ヘルペスのウイルス)に人工的に3つのウイルス遺伝子を改変した第三世代のがん治療用ヘルペスウイルス G47Δ の臨床開発を進めてきた。
第一三共は、藤堂教授と共同で開発しているがん治療用ウイルスG47Δについて、 脳腫瘍の一種の膠芽腫の患者を対象に実施した医師主導治験において有効性と安全性が確認されたため、2020年12月28日、悪性神経膠腫に係る再生医療等製品製造販売承認申請を国内で行った。2021年6月11日悪性神経膠腫を適応症とした再生医療等製品(一般名 テセルパツレブ、製品名 デリタクト注)として承認された。
補正加算として市場性加算Iの10%、先駆け審査指定制度加算10%がつけられ、薬価は1mL1瓶143万1918円に設定した。市場規模はピーク時の10年目に208人、販売額は12億円と予測している。神経膠腫(グリオーマ)は、原発性脳腫瘍のおよそ4分の1を占める。悪性度に従って4段階に分けられるが、治験の対象となった膠芽腫(グリオブラストーマ)は、最も頻度が高く予後も悪い悪性度4の神経膠腫で、手術をしてから放射線治療と化学療法を行っても、平均余命は診断から18カ月、5年生存率は10%程度とされる。G47∆(デリタクト注)の適応対象となるのは、悪性度3と4の悪性神経膠腫である。
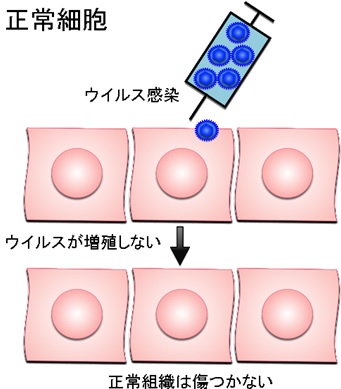
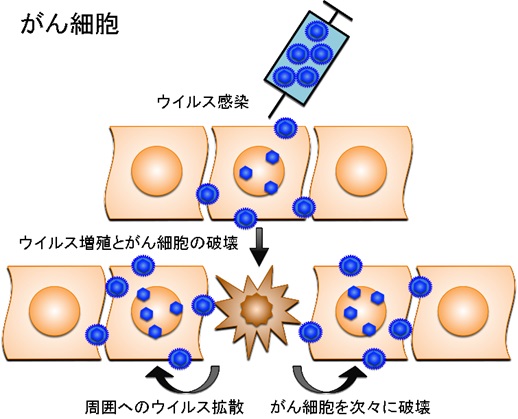
がんのウイルス療法とは、がん細胞のみで増えることができるウイルスを感染させ、ウイルスが直接がん細胞を破壊する治療法。遺伝子工学技術を用いてウイルスゲノムを「設計」して、がん細胞ではよく増えても正常細胞では全く増えないウイルスを人工的に造って臨床に応用する。がん細胞だけで増えるように工夫された遺伝子組換えウイルスは、がん細胞に感染するとすぐに増殖を開始し、その過程で感染したがん細胞を死滅させる。
増殖したウイルスはさらに周囲に散らばって再びがん細胞に感染し、ウイルス増殖、細胞死、感染を繰り返してがん細胞を次々に破壊してい く。一方、正常細胞に感染した遺伝子組換えウイルスは増殖できないような仕組みを備えているため、正常組織は傷つかない。
G47Δは、口唇に水疱ができる口唇ヘルペスの原因ウイルスとして知られている単純ヘルペスウイルス1型の3つのウイルス遺伝子を改変して、藤堂教授らが作製した世界初の第三世代のがん治療用遺伝子組換えヘルペスウイルス 。
単純ヘルペスウイルス1型は、がん治療に有利な特長を多く備えている。1)ヒトのあらゆる種類の細胞に感染できること
2)細胞を殺す力が比較的強いこと
3)抗ウイルス薬が存在するため治療を中断できること
4)患者がウイルスに対する抗体を持っていても治療効果が下がらないこと単純ヘルペスウイルス1型のゲノムから、がん細胞だけで増えるウイルスを造ることができた。
単純ヘルペスウイルス1型の3つのウイルス遺伝子を改変した。これにより、
がん細胞では、増殖したウイルスはウイルス増殖、細胞死、感染を繰り返してがん細胞を次々に破壊していく。
正常細胞に感染した遺伝子組換えウイルスは増殖できない。
3つのウイルス遺伝子を改変したG47Δは、既存のがん治療用ウイルスに比べて安全性と治療効果が格段に高くなっている。
また、大きな特徴として、複製した増えたG47Δが、破壊したがん細胞とともに免疫に排除される過程で、がん細胞が免疫に非自己として認識されて、抗がん免疫が惹起されるため、G47Δを投与した部位のみならず、遠隔のがんに対しても免疫を介して治療効果が期待できる。さらに、G47Δは、がんの根治を阻むとされるがん幹細胞をも効率よく破壊することが判っている。
| ウイルスの | ヒトの正常細胞 | ヒトのがん細胞 | |
| 「γ34・5」遺伝子 | ヒトの体には、ウイルスに感染した細胞が自滅し、ウイルス増殖を防ぐ仕組みがある。 ウイルスのγ34・5遺伝子はこれを食い止め、宿主である細胞を生き続けさせようとする。 |
遺伝子改変でこの働きをなくせば、ウイルス増殖を防ぐ仕組みは維持できる。 | がん細胞ではウイルスに感染したら自滅する機能がそもそも壊れているため、ウイルスのγ34・5遺伝子が働かなくても、がん細胞内では増殖が可能。 |
| 「ICP6」遺伝子 | ウイルスのDNAを合成する酵素を作る遺伝子 | この働きを阻害すれば、ウイルスは正常細胞で増殖できなくなる。 | がん細胞はそれ自体の増殖が活発でDNA合成に必要な酵素が多く存在する。 そのため、ウイルスはICP6の働きがなくても、がん細胞では増えることができる。 |
| (2遺伝子により) | 正常細胞ではウイルスは増殖しない。 | がん細胞ではウイルスは増殖 | |
| (問題点) | (「ヒトの免疫が邪魔し、がん細胞を破壊する能力が落ちてしまうのでは?) | ||
| 「α47」遺伝子 | ウイルスを人体の免疫システムに見つかりにくくする「隠れみの」のような機能を持つ。 | この機能を人工的になくし、逆に免疫が強く働く。 | がんは患者自身の細胞なので、免疫システムに敵だと認識されない。 しかし、隠れみのを失ったウイルスが感染して「目印」となることで、がん細胞が見つかりやすくなり、免疫の攻撃対象となった。 壊れたがん細胞に特有のたんぱく質も免疫は異物と認識し、攻撃がさらに増すことも分かった。 |
コメントする