大塚製薬と米国子会社のOtsuka Pharmaceutical Development & Commercialization, Inc.は11月25日、同社のVOYXACT®(一般名:シベプレンリマブ)が、"進行リスクのある成人のIgA腎症におけるタンパク尿の減少"の効能で、米国FDAより迅速承認を取得したと発表した。
本剤は処方薬ユーザーフィー法(Prescription Drug User Fee Act)による優先審査が認められていた。(製薬企業が新薬の承認審査を受ける際に、FDAに手数料を支払うことを義務付けた法律で、この法律により、FDAは審査費用を賄い、審査体制を強化することで、新薬の承認審査を迅速化する。)
IgA腎症は、進行性の自己免疫性慢性腎臓病であり、20~40歳の成人に発症する場合が多い。現在の標準治療では多くの患者が生涯のうちに末期腎不全に至る可能性がある。
タンパク尿の減少は腎機能悪化遅延と相関する代替マーカーであり、本剤の臨床試験において迅速承認を支持する主要なエンドポイントとして用いられた。
VOYXACTは、フェーズ3試験の中間解析において、投与9ヵ月後時点で、タンパク尿改善の指標であるuPCR(尿蛋白/クレアチニン比)をプラセボ群と比較して、51.2%有意に減少させた。安全性はプラセボと同等であり、良好な忍容性が確認されている。
長期的に腎機能の低下を抑制するかどうかは、まだ確立されていない。
VOYXACTは自己投与が可能な皮下投与のプレフィルドシリンジ製剤で、患者が4週間ごとに在宅投与できる利便性がある。
VOYXACT(シベプレンリマブ)は、大塚製薬の子会社であるVisterra Inc.が創製し、IgA 腎症の発症機序に関与しているAPRIL(A-Proliferation-Inducing Ligand:増殖誘導リガンド )に選択的に結合することでその活性を阻害するモノクローナル抗体である。
シベプレンリマブは、APRILを阻害することで、IgA腎症における腎障害の進行や末期腎不全への進行を遅らせることが期待される。
ーーー
Otsuka Americaは2018年7月に現金430百万米ドルでVisterra Inc.を買収した。
元の株主のTOP5 は下記の通りで、Bill and Melinda Gates Foundationや、シンガポール政府の投資会社Temasek が含まれている。
Polaris Partners 17.2% Flagship Pioneering 15.3% Bill and Melinda Gates Foundation 10.6% Merck Research Lab Venture Fund 10.2% Temasek Holdings 10.2%
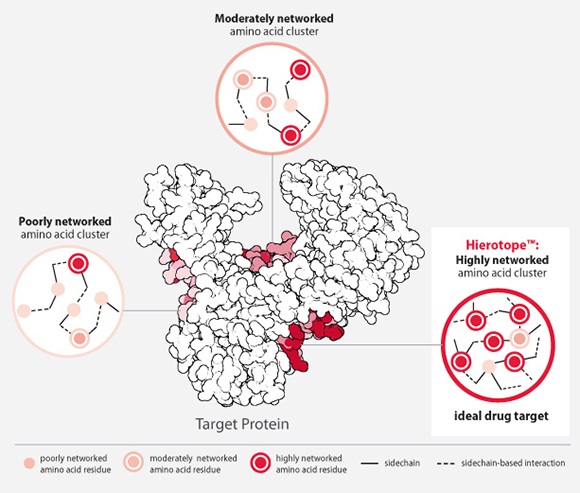
Visterraは、タンパク質の機能に必須と考えられる部分の立体構造をコンピューター上で推定し、同じくコンピューター上で推定した無数の抗体の部分構造と結合シミュレーションを行い、最適な抗体構造を発見し、抗体医薬を設計する独自の抗体プラットフォーム技術(Hierotope platform)を有している。
これにより、従来難しいと考えられていた多くの生体物質に対する抗体医薬品を開発できる可能性がある。
.....
コメントする