欧米の製薬大手が中国の製薬会社から相次いで新薬候補の開発・販売権を取得している。
激しい競争のもとで各社は新薬の開発に注力しており、どこの国のものであれ、特許情報等で可能性があると判断した候補薬剤を競って入手しようとしている。
1)米Merck
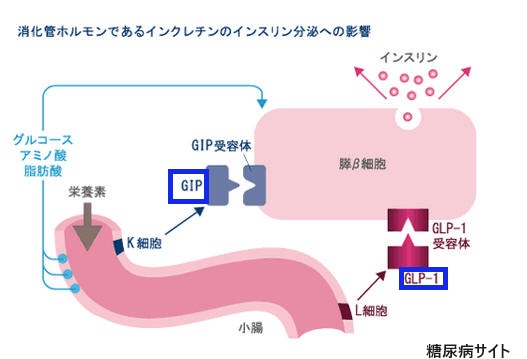
「GLP-1受容体作動薬」または「グルカゴン様ペプチド-1受容体作動薬」は、体内で生成されるGLP-1というホルモンと似た働きをする薬で、GLP-1は、血糖値を下げるインスリンの分泌を促進し、食欲を抑制する効果がある。
このため、最近は新タイプの肥満症治療薬として各社が競っている。
(GLP-1受容体活性化に加え、グルコース依存性 インスリン分泌刺激ポリペプチド のGIP受容体を活性化させるものもある。)
CNBCによると、各社の開発状況は下記の通り。
製品名
メーカー
用法
米承認
Wegovy
Novo Nordisk
週1回の注射
2021 承認
GLP-1を活性化
Zepbound
Eli Lilly
週1回の注射
2023 承認
GLP-1とGIPを活性化
Saxenda
Novo Nordisk
週1回の注射
2020 承認
GLP-1を活性化
MariTide
Amgen
月1回の注射
Experimental
GLP-1を活性化し、GIPをブロック
Danuglipron
Pfizer
1日1回の錠剤
Experimental
GLP-1を活性化
VK2735
Viking Therapeutics
週1回の注射
Experimental
GLP-1とGIPを活性化
Pemvidutide
Altimmune
週1回の注射
Experimental
GLP-1を活性化
GSBR-1290
Structure Therapeutics
週1回の錠剤
Experimental
GLP-1を活性化
Survodutide
Zealand Pharma,
Boehringer Ingelheim週1回の注射
Experimental
GLP-1とグルカゴンを活性化
2024/4/15 新タイプの肥満症治療薬が急増
ライセンス契約では、翰森製薬集団はMerckにHS-10535をグローバルに開発・生産・販売する独占的な権利を与える。見返りに翰森製薬集団は1億1,200万ドルの一時金を受け取るほか、開発、規制当局の承認および商業化に関連するマイルストーンに応じて、最大19億ドルの支払いを受け取る可能性がある。また、売上に応じたロイヤルティも受け取る。
翰森製薬集団は特定の条件で中国においてHS-10535を単独またはMerckと共同でHS-10535を商業化できる。
コメントする