信州大学医学部と東京大学医科学研究所らの研究グループは、抗癌免疫を引き起こす能力を強化した機能付加型の第三世代がん治療用ヘルペスウイルス(T-hIL12)を用いた悪性黒色腫の治験で、高い治療効果を確認したと発表した。
切除不能又は転移性悪性黒色腫の未治療患者に対し、4回の腫瘍内投与を行ったところ、ウイルス投与後24週経過した9例で奏効率(癌が消失or縮小した患者の割合)が77.8%あり、標準治療の奏効率(34.8%) と比較し、極めて高い有効性を示した。
なお、投与後の副作用で最も頻度が高かったのは「一時的発熱」「一時的リンパ球数減少」で、高い安全性が再確認された。
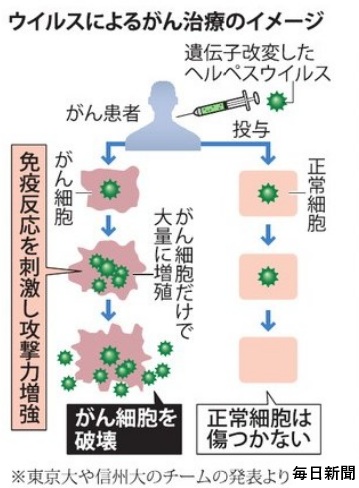
ウイルス療法は、がん細胞に感染させたウイルスが増えることによって直接がん細胞を破壊する手法で、革新的ながん治療法として期待される。
T-hIL12は悪性神経膠腫(脳腫瘍)を適応症として2021年に国内で市販が開始されたG47Δ(一般名 テセルパツレブ、製品名 デリタクト注)に免疫刺激機能を付加した新型ウイルスで、その開発は、発明から医師主導治験に至るまで、研究者だけで推し進めてきた。
悪性黒色腫を適応症としたT-hIL12の製造販売承認申請の実現性は非常に高く、今後治験を加速させる。承認されれば、世界初の機能付加型の第三世代がん治療用ヘルペスウイルス薬となる 。
ーーー
悪性黒色腫(メラノーマ)は、メラニン色素産生能を有するメラノサイトのがん化によって生じる悪性腫瘍で、主に皮膚及び粘膜部に発生する。
転移を起しやすく、原発性皮膚がんによる死亡のおよそ半数を占める難治性の皮膚がん。
切除可能な悪性黒色腫は切除によって局所再発の減少や生存率の改善などが期待されるが、転移が生じると治癒は難しくなる。
近年、本邦では、進行期悪性黒色腫を適応対象とする免疫チェックポイント阻害薬や分子標的薬が承認され治療に用いられてい るが、免疫チェックポイント阻害薬でも奏効率は単剤で約10~30%台に過ぎず、疾患特異的生存期間の中央値も1.5年前後と、その治療効果は必ずしも十分では なく、重い副作用も治療上問題となる。
免疫チェックポイント阻害薬は、免疫細胞のブレーキを解除し、がん細胞を攻撃する力を高める薬
抗PD-1抗体: PD-1という免疫細胞のブレーキ分子に結合し、免疫細胞の活性化を促す。
ニボルマブ(商品名: オプジーボ)やペムブロリズマブ(商品名: キイトルーダ)など抗CTLA-4抗体: CTLA-4という別のブレーキ分子に結合し、免疫細胞の活性化を促す。
併用療法: 抗PD-1抗体と抗CTLA-4抗体を併用
イピリムマブ(商品名:ヤーボイ)
がんのウイルス療法は、がん細胞のみで増えることができるウイルスを感染させ、ウイルスが直接がん細胞を破壊する治療法。
ウイルス療法では、遺伝子工学技術を用いてウイルスゲノムを「設計」し、がん細胞ではよく増えても正常細胞では全く増えないウイルスを人工的に造って臨床に応用 する。がん細胞に感染するとすぐに増殖を開始し、その過程で感染したがん細胞を死滅させる。増殖したウイルスはさらに周囲に散らばって再びがん細胞に感染し、ウイルス増殖、細胞死、感染を繰り返してがん細胞を次々に破壊していく。
一方、正常細胞に感染した遺伝子組換えウイルスは増殖できないような仕組みを備えているため、正常組織は傷つけない。
遺伝子組換えウイルスを用いたウイルス療法の臨床開発は、近年世界で競争が加速しており、中でも、単純ヘルペスウイルス1型を応用した開発が先頭を走っており、2015年にはAmgenが開発した第二世代のがん治療用ヘルペスウイルス製品(talimogene laherparepvec 略称:T-VEC)が悪性黒色腫の治療薬として欧米で認可された。Amgenの子会社であるBioVex Inc.が製造する。
G47Δ(一般名 テセルパツレブ、製品名 デリタクト注)は、3つのウイルス遺伝子を改変した世界初の第三世代遺伝子組換えヘルペスウイルスで 、それまでのがん治療用ウイルスに比べて安全性と治療効果が格段に高くなっている。
G47Δ は東京大学医科学研究所 藤堂具紀教授と第一三共が共同で開発
2021年6月に承認され、2021年11月に第一三共が「デリタクト®注」(一般名:テセルパツレブ)として国内で発売した。
G47Δは2つの機序を介して抗がん作用を現す。
1つめは、がん細胞にG47Δが感染して細胞内で増殖し、がん細胞を直接破壊する。増えたG47Δは、周囲のがん細胞に感染し、がん細胞を次々に破壊していき、一定の期間増えたあと免疫に排除され る。
2つめは、がん細胞で増えたG47Δを免疫が排除する過程で、破壊されたがん細胞もG47Δと一緒に免疫に処理される結果、がん細胞が免疫系に初めて非自己として認識されて免疫の攻撃対象となる。
抗がん免疫を効率よく惹起するために、G47Δを投与した部位のみならず、投与していないところにあるがんにも免疫を介して効果が期待できる。またがん細胞が免疫系に認識されるため、G47Δで治療を行った患者は、免疫チェックポイント阻害薬が効く確率が高くなると考えられる。
さらに、G47Δは、がんの根治を阻むとされるがん幹細胞をも効率よく破壊することが判っている。
G47Δは悪性脳腫瘍、前立腺癌、嗅神経芽細胞腫、悪性胸膜中皮腫に対して国内で臨床試験が行われ、2021年に、悪性神経膠腫(脳腫瘍)を適応症として日本初のウイルス療法薬(再生医療等製品、一般名テセルパツレブ、製品名デリタクト注)として製造販売承認(条件及び期限付)され、市販が開始された。
T-hIL12は、G47Δの基本骨格に免疫を強力に刺激する因子であるインターロイキン12(IL-12)の遺伝子を組み込み、抗がん免疫を引き起こす能力を強化した藤堂教授らが作製した世界初の機能付加型の第三世代がん治療用遺伝子組換えヘルペスウイルスで、G47Δと同じ3つのウイルス遺伝子が改変されているため、G47Δと同様に高い安全性と強い治療効果が期待できる。さらにT-hIL12は、がん細胞に感染するたびにヒトIL-12を産生するため、G47Δの2つめの作用機序、すなわち抗がん免疫を介した効果を増強し、強力な抗がん免疫作用を呈する。
単純ヘルペスウイルス1型は、ウイルスのゲノムに任意の治療遺伝子を組み込むことにより、特定の抗がん機能を付加することが可能だが、G47Δの基本骨格に、任意の外来遺伝子を短期間に的確に組み込むことができる画期的技術を開発した。この技術を用いることにより、さまざまな機能付加型G47Δを作製することが可能になった。
免疫を刺激する蛋白質の遺伝子をG47Δに組み込むと、抗がん免疫を引き起こす機能が一層増強したG47Δができる。動物実験などで、IL-12が高い治療効果を示したため、機能付加型G47Δの臨床応用の第一弾としてT-hIL12の治験を進めてきた。
T-hIL12は、G47Δよりさらに効率的に抗がん免疫を誘導して一層強い治療効果を発揮するため、T-hIL12を投与した部位のみならず、投与していない遠隔のがんにも免疫を介して治療効果が期待でき る。
今後、承認申請と審査を経て、抗がん免疫刺激機能を付加した第三世代がん治療用ヘルペスウイルスとして世界初の承認薬となる見込み。
コメントする