柏崎刈羽原子力発電所について、東京電力は6月25日、先行して準備を進めてきた7号機に代わり、6号機の再稼働を優先することを決めたと発表した。
問題は、6号機、7号機ともにテロ対策施設が完成していないことである。これが未完成の場合、稼働できないが、通常の審査終了後5年間は猶予されている。
テロ対策施設は「特定重大事故等対処施設」と呼ばれ、2011年の福島第一原発事故後にできた新規制基準で設置が義務付けられた。
原子炉から離れた場所に建て、遠隔制御で原子炉を冷やす設備を備える。原子炉が航空機の衝突などによる攻撃を受けても、電源や冷却機能などを失わないようにする。
6号機は設置期限が2029年9月、7号機は2025年10月である。それまでは稼働できる。
原子力規制委員会は2019年4月24日の定例会合で、原発に設置が義務付けられているテロ対策施設が期限内に完成しない場合、 期限の延長を認めないことを決めた。原則として原発の運転停止を命じる。
東京電力は2025年2月27日、再稼働を目指している7号機のテロ対策施設の完成が遅れ、設置期限の10月に間に合わないと発表した。
7号機のテロ対策施設は今年3月に完成予定としていたが、難工事だった上、人手不足などから遅れ、2029年8月に延期した。
7号機の場合、昨年4月に原子炉に核燃料を装塡しており、地元の同意を得ることができれば、再稼働できる状態だった。猶予期限の今年10月までは稼働できるが、それ以降は完成する2029年まで稼働できない。
一方、6号機は設置期限が2029年9月で、それまでの猶予期間は稼働できる。東電は核燃料を今年6月に装塡する計画を示しており、6号機を今夏にも再稼働させたい考え。
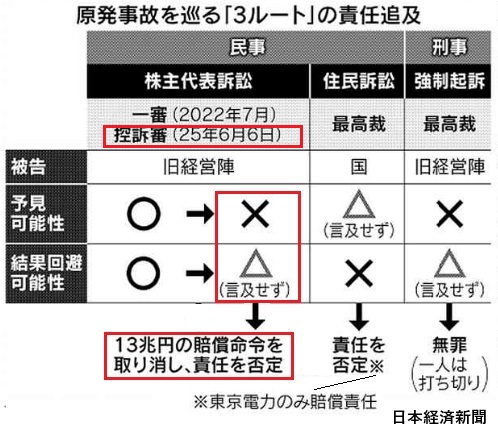
| 核燃料装填 | テロ対策設置期限 未設置の場合、操業停止 |
テロ対策設置予定 | テロ対策完了前の稼働可能期間 (地元の同意が前提) |
||
| 6号機 | 2025/6/21 | 2029/9 | 当初2026/9→2031/9 6号機遅れの影響 | 稼働→2029/9 | 地元同意は9月 降となる。 |
| 7号機 | 2024/4 | 2025/10 | 当初2025/3→2029/8 難工事、人手不足 | 稼働→2025/10 | |
東電では当初、準備が先行する7号機について、地元同意が得られて再稼働したとしても9月末には停止する必要があるが、短期間でも優先で再稼働させたい考えを示した。
一方、設置期限が2029年9月の6号機については今夏以降にも再稼働させたいとした。6号機はテロ対策施設の設置期限まで4年程度の余裕があるほか、今月21日、原子炉に核燃料を入れる作業が終わるなど、再稼働に向けた準備も進んでいる。
いずれにしても、地元の同意が大前提であるが、新潟県の花角知事は、県民の意見を聞く「公聴会」が終わる今年8月末以降に再稼働の是非を判断する見通しで、地元の同意が得られるとしても9月以降となり、7号機を再稼働させるのは難しくなった。
こうしたことから柏崎刈羽原発の稲垣武之所長は、25日の記者会見で6号機の再稼働を優先することを決めたと正式に発表した。今後、7号機の原子炉に入っている核燃料を取り出し、燃料プールに戻すことも検討する。
稲垣所長は「6号機にリソースを集中させ、設備の健全性の確認など再稼働に向けた準備を進めていきたい」と述べた。
なお、立地する柏崎市と刈羽村では再稼働への理解が進んでいるといえる。両市村では昨年11月、任期満了に伴う首長選が行われ、柏崎市長選は再稼働を条件付きで容認する姿勢を示す現職の桜井雅浩氏が大差で3選。刈羽村長選は、再稼働を容認している品田宏夫氏が無投票で7選を果たした。
桜井市長は3選を決めた際に、「再稼働の是非について判断を下し、その判断について県民に信を問う時期に来ている」と述べ、花角知事に対応を促した。
品田村長も「原発が発電することで村が回っていく。それが村の望む姿だ」と再稼働の必要性を訴えた。
しかし、花角英世知事は再稼働の賛否を明らかにしていない。
花角知事は2023年5月、再稼働の判断にあたって、まず「議論の材料」が必要と主張した。
①福島第一事故の「三つの検証」②柏崎刈羽原発の運転禁止命令の解除③同原発の安全性確認④事故時の避難を巡る取り組みで、これらは既に出揃った。
その後に「県民の受け止めを見極める」手続きが必要としており、公聴会、首長との対話、県民意識調査を挙げていた。県は公聴会の日程を6月29日~8月31日と発表、その後に「リーダーとして判断する」としている。
これについて6月19日の県議会の代表質問で県議が、辺野古基地建設を当時の知事が承認した後、知事選や県民投票で反対の民意が示されても工事が止まらないことを引き合いに出し、「県民の意思を反映させるには、国に対して再稼働への理解要請に回答する前に県民の意思を確認するべきだ」と問いかけた。
これに対し知事は、「県民の意思を確認した後、国からの理解要請へ回答することになる」と述べた。意思を確認する方法については明確にしなかったが、選挙などで「信を問う」ことも例示した。
一方、再稼働の是非を判断する時期について問われると「現在、県民の多様な意見の把握に努めているところ。結論を申し上げる段階にない」とした。
同意についての判断は事実上、9月以降にずれ込むことになる。



最近のコメント